冷冻保存骨组织的方法与流程
1.本发明属于生物技术领域,具体涉及冷冻保存骨组织的方法
。
背景技术:
2.虽然采用人造骨骼能够快速解决骨组织缺损及防止因骨癌等因素回植造成的复发等问题,但人造骨骼材料的价格远超患者经济承受范围,同时无法避免患者因接受人造骨骼移植后出现“物非原主”导致的心理焦虑和不可预期的心理压力
。
从提高患者康复效果的角度分析,患者仍然希望使用符合手术条件的自体骨组织,从临床治疗效果分析,使用自体骨组织能够有效提高并保持患者接受手术后的骨骨窗愈合速度,有效降低异体或人造骨引发的排异反应,提升与患者手术沟通效果进而提高治疗成功率
。
因此,目前大多数医务工作者和患者均倾向于使用自体来源的骨材料用于手术后对组织缺损部位进行回植修复
。
3.但是目前报道的骨组织保存技术由于缺乏完整的操作流程,缺乏骨组织在处理阶段采用不同消毒药品处理样本后对其质量影响的相关数据
。
目前常使用的骨组织保存方法分别为湿法保存
、
低温保存和常温保存,湿法保存如上所述普遍存在脱钙问题,保存过程中难以维持钙平衡,无法保证骨组织经过长期保存后的物理特性
。
低温保存法采用-80℃
甚至-196℃
深低温冻存,能够较好保持骨组织活性,然而回植前复苏和水合过程一旦操作不当,极易损伤骨组织物理学特性,造成骨组织材料崩裂等现象,且复苏和水合步骤繁琐,容易引起骨组织材料污染
。
常温保存适用于保存过程中对脱钙或脱蛋白要求略低的骨组织材料,在保存过程中仍然存在脱钙和物理特性下降等现象
。
技术实现要素:
4.本发明所提供的骨组织的方法采用覆膜真空联合深低温保存技术,结合梯度降温冻存技术,通过真空和深低温外界条件,将颅骨组织细胞代谢水平降低至能够维持其活力的最低水平,采用适宜的梯度降温程序,最大程度保持颅骨组织保存过程中的物理特性,从而提高保存时间和质量
。
5.具体地,本发明提供了以下技术方案:
6.第一方面,本发明提供了一种冷冻保存骨组织的方法,所述方法包括以下步骤:
7.1)
收集骨组织并放置于充满保存液的保存装置中;
8.2)
排空空气;
9.3)
以
1℃/min
匀速降至-20℃
,再以
10℃/min
快速降至-80℃
,最后以
25℃/min
降至-196℃。
10.优选地,所述步骤
1)
中需要确保保存液可以浸润骨组织表面;更优选地,可以根据v=
h*s*2
计算保存液的加注量
(v:
保存液体积;h:保存液在颅骨表面形成的凝胶厚度,一般为
2-3mm
;
s:
颅骨骨瓣表面积,手术行骨瓣减压术按照标准表面积取骨
)。
11.进一步地,所述骨组织经以上步骤处理后置于液氮中进行长期保存
。
12.优选地,所述骨组织是经过清洗
、
打磨
、
灭菌
、
润洗处理的
。
13.更优选地,所述清洗使用的试剂是生理盐水和
/
或清洗液,所述清洗液中包含卡迪姆碘和微晶纤维素
。
14.优选地,所述清洗液中的卡迪姆碘的浓度为
0.01
%-0.05
%
。
15.优选地,所述清洗液中的微晶纤维素的浓度为
0.01
%-0.02
%
。
16.优选地,所述灭菌的方式是辐照灭菌
。
17.如本发明所述术语“辐照灭菌”、“辐照除菌”是指利用电离辐射产生的电磁波杀死大多数物质上的微生物的一种有效方法
。
用于灭菌的射线类型包括
α
射线
、
β
射线
、x
射线和
γ
射线;其中,
α
射线和
β
射线是粒子束,
x
射线和
γ
射线是电磁波
。
18.优选地,本发明所述辐照灭菌使用
x
射线
。
19.优选地,所述辐照灭菌的剂量可以是
20-50gy
,具体地包括
20gy、25gy、30gy、35gy、40gy、45gy、50gy。
20.优选地,所述辐照灭菌的剂量是
25gy。
21.本发明所述
gy
即“gray”的缩写,是物理量“电离辐射能量吸收剂量”的标准单位
。gray
可译作“戈瑞”、“戈雷”、“格雷”,有时简称“戈”,在本发明中以上概念皆代表相同含义,可互换使用
。
22.优选地,所述润洗是指使用保存液清洗骨组织
。
23.更优选地,取润洗所使用的保存液进行检测,所述检测包括真菌
、
细菌
、
内毒素和支原体等检测项目
。
检测合格则可以进入下一个保存处理步骤,检测不合格的骨组织可再次进行辐照灭菌
。
24.具体地,所述检测包括采用培养法进行无菌检测,采用鲎试剂进行内毒素定量检测
。
25.最优选地,所述骨组织经过以下预处理:打磨去除骨组织材料表面毛刺,经生理盐水和清洗液反复清洗残留的血渍和骨粉,尽可能去除残留血块和组织碎屑;使用含有
0.01
%-0.5
%的卡迪姆碘和
0.01
%-0.02
%的微晶纤维素的清洗液清洗骨组织后通过辐照除菌
。
26.优选地,所述保存液中含有卡迪姆碘
、
微晶纤维素
、
人血白蛋白
、
磷酸缓冲溶液
、
氯化钙和氯化钾
。
27.优选地,所述保存液中含有
0.01
%-0.05
%卡迪姆碘
、0.01
%-0.02
%微晶纤维素
、7
%人血白蛋白
、0.02
%磷酸缓冲溶液
、0.02
%-0.04
%氯化钙和
0.01
%-0.02
%氯化钾
。
28.最优选地,所述保存液中含有
0.05
%卡迪姆碘
、0.02
%微晶纤维素
、7
%人血白蛋白
、0.02
%磷酸缓冲溶液
、0.04
%氯化钙和
0.01
%氯化钾
。
29.优选地,所述保存液的
ph
值是
7.0-7.2。
30.优选地,所述保存装置包括保存袋
、
保存盒
、
保存管等任意类型的容器
。
优选地,所述保存装置的材质可以是聚酰亚胺
(pi)。
在本发明的具体实施例中所使用的保存装置是保存袋
。
31.本发明所述“骨组织”可以来自于任何动物包括但不限于人
、
猩猩
、
猴
、
马
、
牛
、
羊
、
猪
、
驴
、
骆驼
、
狗
、
兔
、
猫
、
大鼠
、
小鼠
、
鱼
、
鸟或昆虫等
。
所述骨组织的来源可以是颅骨
、
躯干骨和四肢骨
。
32.优选地,所述骨组织来自于人
。
33.最优选地,所述骨组织是颅骨组织
。
34.如本发明所述术语“卡地姆碘
(cadexomer iodine)”是一种外用杀菌剂,是碘和卡地姆的络合物,含碘浓度
0.9
%
。
35.如本发明所述术语“微晶纤维素”,简称
mcc(microcrystalline cellulose)
,主要成分为以
β-1,4-葡萄糖苷键结合的直链式多糖类物质,是天然纤维素经稀酸水解至极限聚合度的可自由流动的极细微的短棒状或粉末状多孔状颗粒,组成的白色
、
无臭
、
无味的结晶粉末
。
36.在本发明具体实施例中通过真空仪排空空气,通过程控降温仪控制降温程序
。
具体是,采用真空仪从保存装置
(
保存袋
)
真空排气导管排出剩余气体,真空过程遵循少量多次,确保保存装置
(
保存袋
)
紧密贴合颅骨组织表面,完成真空排气后,密封排气导管管口,将保存装置
(
保存袋
)
置于程控降温仪,后按照本发明所提供的降温程序降温
。
37.另一方面,本发明提供了一种保存液,所述保存液中含有卡迪姆碘
、
微晶纤维素
、
人血白蛋白
、
磷酸缓冲溶液
、
氯化钙和氯化钾
。
38.优选地,所述保存液中含有
0.01
%-0.05
%卡迪姆碘
、0.01
%-0.02
%微晶纤维素
、7
%人血白蛋白
、0.02
%磷酸缓冲溶液
、0.02
%-0.04
%氯化钙和
0.01
%-0.02
%氯化钾
。
39.最优选地,所述保存液中含有
0.05
%卡迪姆碘
、0.02
%微晶纤维素
、7
%人血白蛋白
、0.02
%磷酸缓冲溶液
、0.04
%氯化钙和
0.01
%氯化钾
。
40.优选地,所述保存液的
ph
值是
7.0-7.2。
41.另一方面,本发明还提供了前述保存液在在保存骨组织中的应用
。
42.本发明所述“骨组织”可以来自于任何动物
(
例如,哺乳动物
)
,包括但不限于人
、
非人灵长类动物
、
啮齿类动物等
。
43.优选地,所述骨组织的来源包括但不限于颅骨
、
躯干骨和四肢骨
。
44.优选地,所述骨组织来自于人
。
45.最优选地,所述骨组织是颅骨组织
。
46.在一种具体地实施例中,所述骨组织是自体组织,也即,将取自于患者自身的骨组织移植给患者本人
。
47.另一方面,本发明提供给了经前述方法保存的骨组织以及其在骨移植中的应用
。
同时提供给了包含前述方法保存的骨组织和保存液所组成的组合物,所述组合物中还可以包括保存装置
。
48.具体地,所述骨组织长期保存仍维持高质量的物理特性,脱钙率低
。
49.相比于现有技术,本发明至少具有以下有益效果:
50.本发明所提供的保存方法是利用保存液中微晶纤维素在真空作用下使骨组织表面形成极薄的覆盖凝胶,替代直接冻干技术,结合程序降温原理,使颅骨组织逐渐适应深低温环境的保存条件,最大限度降低冻存过程中对颅骨组织物理特性的不利影响
。
附图说明
51.图1是颅骨组织保存流程
。
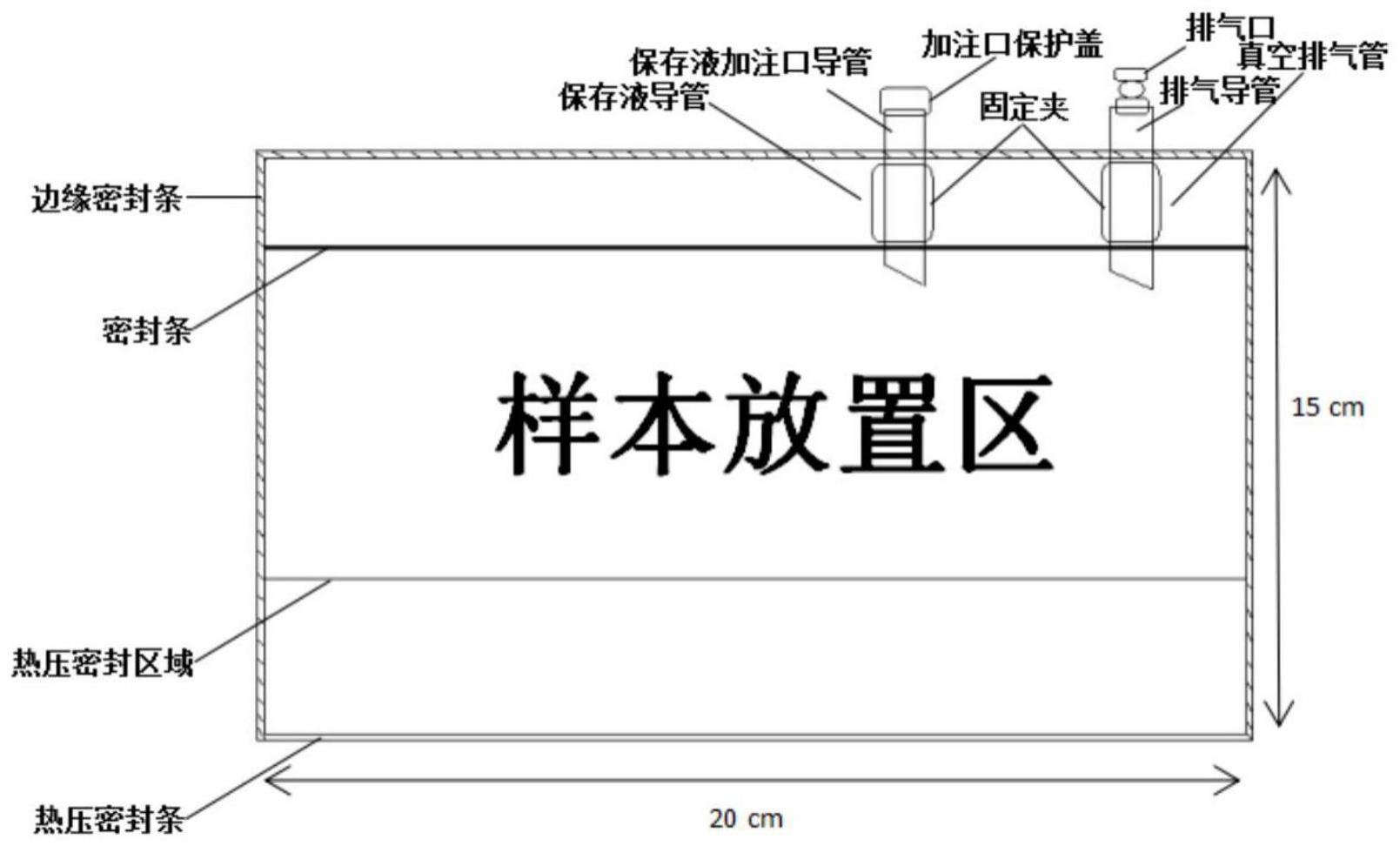
52.图2是颅骨保存袋平面结构示意图
。
53.图3是分组7的样本保存
12
个月颅骨骨瓣外板密质骨扫描电镜图
。
54.图4是分组1的样本保存6个月颅骨骨瓣部分板障区松质骨骨小梁结构扫描电镜图
。
55.图5是分组4的样本保存6个月颅骨大骨瓣板障区松质骨骨小梁和网眼结构扫描电镜图
。
56.图6是分组4的样本保存
12
个月颅骨外板结构扫描电镜图
。
57.图7是分组1的样本保存
12
个月颅骨外板结构扫描电镜图
。
具体实施方式
58.下面结合实施例对本发明做进一步的说明,以下所述,仅是对本发明的较佳实施例而已,并非对本发明做其他形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例
。
凡是未脱离本发明方案内容,依据本发明的技术实质对以下实施例所做的任何简单修改或等同变化,均落在本发明的保护范围内
。
59.实施例
1、
颅骨组织保存及性能测试
60.1、
试验材料
61.本技术需配置颅骨组织清洗液,颅骨组织保存液和林格氏溶液,溶液中成分包括卡迪姆碘
、
微晶纤维素
、
人血白蛋白
、
磷酸缓冲溶液
、
氯化钙
、
氯化钾,所用药品均使用药用级试剂,无药用等级试剂至少应符合分析纯级别,所有试剂配制完成后依据其物理性质进行除菌操作,待通过无菌质检后方可使用
。
用于颅骨组织无菌检测试剂使用符合
《
中国药典
》
检测标准的检测试剂
。
62.2、
颅骨组织保存流程
63.(1)
颅骨组织材料清洁,颅骨组织来源于新疆医科大学第一附属医院脑外科去骨瓣减压术,手术取得的颅骨组织经打磨去除颅骨组织材料表面毛刺,经医用生理盐水和清洗液反复清洗残留的血渍和骨粉,尽可能去除残留血块和组织碎屑,最后一次清洗使用表1所述颅骨组织清洗液,其成分为:卡迪姆碘:
0.01
%-0.5
%;微晶纤维素:
0.01
%-0.02
%;余量为纯水
。
64.颅骨组织清洗液配制以质量百分比计算并配制保存液,采用万分之一天平进行称量,注射用无菌水进行溶解或稀释
(
卡迪姆碘须使用少量
95
%乙醇溶解配制母液
)
,所有操作均在室温下进行
。
65.表
1、
自体颅骨清洗液配制分组
[0066] 分组1分组2分组3卡迪姆碘
0.01
%
0.25
%
0.5
%微晶纤维素
0.01
%
0.01
%
0.02
%纯水余量余量余量
[0067]
(2)
颅骨组织称重及辐照灭菌,采用医用天平,于洁净区对颅骨组织称重,使用辐照仪
(vitalbeam
直线加速器,美国,
x
射线
)
,设置
25gy
辐照除菌
。
[0068]
(3)
颅骨组织润洗与浸渍,使用足量表2所示保存液润洗颅骨组织两次,取第二次润洗的保存液用于无菌检测,收集用于无菌检测的保存液后尽可能除尽残留的保存液,润洗结束
。
将颅骨组织置于洁净的均质保存袋,热压密封袋口,依据颅骨组织重量,从保存袋保存液加注口注入适量保存液,根据v=
h*s*2(v:
保存液体积;h:保存液在颅骨表面形成的
凝胶厚度,一般为
2-3mm
;
s:
颅骨骨瓣表面积,手术行骨瓣减压术按照标准表面积取骨
)
计算加注量,确保浸润组织表面即可
(
颅骨保存袋平面结构示意图如图
2)。
[0069]
保存液成分为:卡迪姆碘:
0.01
%-0.5
%;微晶纤维素:
0.01
%-0.02
%;人血白蛋白:4%-7
%;磷酸缓冲溶液:
0.01
%-0.03
%;氯化钙:
0.02
%-0.04
%;氯化钾:
0.1
%-0.02
%;余量为纯水
。
[0070]
颅骨保存液配制依据实验室溶液配制及稀释方法,计划配制所需量,根据质量百分数计算称取药品重量,采用万分之一天平进行称量,采用注射用无菌水溶解药品或稀释母液,溶液配制均在室温下进行
。
[0071]
表
2、
自体颅骨保存液配制分组
[0072]
ꢀꢀ
分组1分组2分组3分组4分组5分组6分组7卡迪姆碘
0.50
%
0.25
%
0.01
%
0.50
%
0.50
%
0.50
%
0.50
%微晶纤维素
0.02
%
0.02
%
0.02
%
0.01
%
0.02
%
0.02
%
0.02
%人血白蛋白7%7%7%7%4%7%7%磷酸缓冲溶液
0.02
%
0.02
%
0.02
%
0.02
%
0.02
%
0.02
%
0.02
%氯化钙
0.04
%
0.04
%
0.04
%
0.04
%
0.04
%
0.02
%
0.04
%氯化钾
0.02
%
0.02
%
0.02
%
0.02
%
0.02
%
0.02
%
0.01
%纯水余量余量余量余量余量余量余量溶液
ph
值
7.0-7.27.0-7.27.0-7.27.0-7.27.0-7.27.0-7.27.0-7.2
[0073]
(4)
颅骨组织冷冻保存,采用真空仪从保存袋真空排气导管排出剩余气体,真空过程遵循少量多次,确保保存袋紧密贴合颅骨组织表面,完成真空排气后,密封排气导管管口,将保存袋粘贴标签移入保存盒置于程控降温仪,依据本技术所述降温程序,完成程序降温后,移入-196℃
进行深低温保存
。
本技术所述降温程序如下:以室温
20℃
为例,在程控降温仪中以
1℃/min
匀速降至-20℃
,再以
10℃/min
快速降至-80℃
,最后以
25℃/min
降至-196℃。
[0074]
3、
内毒素定量检测及结果
[0075]
无菌检测包括冻存前无菌检测和复苏后无菌检测,包括真菌
、
细菌
、
内毒素和支原体检测项目
。
冻存前无菌检测:收集润洗颅骨组织的保存液采用培养法进行无菌定性检测,采用鲎试剂对内毒素进行定量检测;复苏后无菌检测:从保存袋取出颅骨组织,使用林格氏溶液和医用生理盐水反复冲洗颅骨表面两次,尽可能彻底去除保存液,再使用医用生理盐水冲洗两次颅骨组织,第一次清洗林格氏溶液,第二次润洗颅骨组织,润洗完毕后进行无菌检测,收集第二次生理盐水润洗颅骨组织后的清洗液,采用培养法进行无菌检测,采用鲎试剂进行内毒素定量检测
。
[0076]
1)
冻存前无菌检测结果
[0077]
采用培养法检测微生物
(
包括真菌和细菌
)
和支原体,采用鲎试剂定量检测内毒素,表3显示4组样本冻存前无菌检测结果
。
[0078]
表
3、
冻存前颅骨无菌检测结果
[0079][0080]
2)
复苏后无菌检测结果
[0081]
表
4、
表5分别显示4组样本采用分组7保存液冻存6个月和
12
个月后采用相同方法和技术对颅骨组织的无菌检测结果
。
[0082]
表
4、
保存6个月后颅骨无菌检测结果
[0083][0084]
表
5、
保存
12
个月后颅骨无菌检测结果
[0085][0086]
综上,依据
《
中国药典
》(2020)
对生物样本检测方法,定性检测结果显示,不同浓度的卡迪姆碘保存液组均能够有效避免细菌
、
真菌及支原体感染,内毒素定量结果检测显示,
0.01
%
(
分组
3)
和
0.25
%
(
分组
2)
及
0.5
%
(
分组
1)
卡迪姆碘保存液内毒素水平在6和
12
个月均呈现上调波动,但仍符合
《
中国药典
》(2020)
对生物样本检测要求,然而
0.5
%
(
分组
1)
卡迪姆碘保存液浓度组相比其他浓度条件组,对保存
12
个月的颅骨组织仍然能够维持较低的内毒素含量,且差异显著,说明该浓度卡迪姆碘保存液能够更有效抑制样本感染,降低革兰氏阴性菌污染率,有效维持细胞生存状态,且根据文献报道,该浓度未见对细胞具有不利影响的相关报道,因此该浓度
(0.5
%卡迪姆碘
)
能够在颅骨冻存过程中维持更长时间的无菌状态,是用于生物样本保存的安全浓度
。
[0087]
4、
观察颅骨组织微观结构
[0088]
将经过上述保存条件冷冻保存后复苏的颅骨组织样品用扫描电镜观察骨组织微观结构,针对外板的密质骨部分,观察外环骨板层结构,哈弗管状系统结构是否完整,针对松质骨的骨小梁部分,观察骨组织细胞排列是否规整和密实,哈弗管系统是否被破坏
。
[0089]
图3是分组7的样本保存
12
个月颅骨骨瓣外板密质骨扫描电镜图
(100
μ
m)
,显示骨瓣外板结构质地紧实
、
哈弗管状系统周边结构排列缜密,未观察到结构塌陷或崩裂现象
。
[0090]
图4是分组1的样本保存6个月颅骨骨瓣部分板障区松质骨骨小梁结构扫描电镜图
(100
μ
m)
显示板障骨组织规整
、
密实,未见哈弗管系统受破坏现象
。
[0091]
图5是分组4的样本保存6个月颅骨大骨瓣板障区松质骨骨小梁和网眼结构扫描电镜图
(100
μ
m)
,显示网眼周围结构平滑,组成致密,无崩裂塌陷等现象
。
[0092]
图6是分组4的样本保存
12
个月颅骨外板结构扫描电镜图
(100
μ
m)
,显示外板结构平整,部分区域存在崩解开裂等现象
。
[0093]
图7是分组1的样本保存
12
个月颅骨外板结构扫描电镜图
(100
μ
m)
,显示外板结构平整,无崩解开裂等现象
。
[0094]
微晶纤维素的高聚合物性质可作为渗透压保护剂和粘合剂,为骨组织细胞低温长期冻存过程中维持渗透压平衡和必要的水合环境,采用分组1和分组4微晶纤维素保存液保存6个月的颅骨组织,其外板及哈弗管系统超显微结构未呈现显著差异
(
图
5)
,对保存
12
个月的颅骨组织超显微结构观察发现,
0.01
%的微晶纤维素组
(
分组
4)
组颅骨组织外板微观结构沉呈现少量崩裂现象
(
图
6)
,相比
0.01
%的微晶纤维素组保存
12
个月的颅骨组织未出现上述现象
(
图
7)
,说明高浓度的微晶纤维素能够更有利于维持接触颅骨组织表面单位面积的水合环境,越不易发生崩解,考虑到分组4出现的外板崩解现象,排除手术和预处理过程等人为损伤因素,使用该含量的微晶纤维素保存液可能不适宜用于长期颅骨组织保存,认为分组
1(0.02
%
)
的微晶纤维素含量能够提高颅骨保存质量,有利于维持颅骨组织的物理特性
。
[0095]
5、
颅骨组织元素分析
[0096]
使用扫描电镜对复苏的颅骨骨瓣组织进行多点连续性元素含量分析,针对
o、ga、p、na
及
cl
等元素进行检测,计算其相对含量,与对照组统计分析后评价本技术对骨组织化学元素含量的影响
。
表6是采用分组1保存4个样本
12
个月的元素分析结果,表7是分组6的结果,表8是分组7的结果
。
[0097]
表
6、
分组1保存液颅骨元素分析结果
[0098][0099]
表
7、
分组6保存液颅骨元素分析结果
[0100][0101]
表
8、
分组7保存液颅骨元素分析结果
[0102][0103][0104]
6、
颅骨组织抗压性质检测
[0105]
对保存后复苏的样品进行耐压检测,测定骨瓣组织受到破坏后的压力值,统计分析后与对照相比,评价颅骨组织的粘弹性和坚固性
。
表9显示采用分组1保存4个样本
12
个月的抗压水平检测结果,表
10
是分组6的检测结果
。
[0106]
表
9、
分组1保存液颅骨压力检测结果
[0107]
编号样本信息
/
检测结果破碎压力值
(n)
破碎千克力
(kgf)1
检测样本
15013511.53 2
检测样本
24415450.51 3
检测样本
33375344.39 4
检测样本
42993305.41
[0108]
表
10、
分组6保存液颅骨压力检测结果
[0109]
编号样本信息
/
检测结果破碎压力值
(n)
破碎千克力
(kgf)1
检测样本
14893499.29 2
检测样本
24115419.90 3
检测样本
32833289.08 4
检测样本
42758281.43
[0110]
7、
自体颅骨组织抗冲击性质检测
[0111]
对保存后复苏的样品测定颅骨冲击韧性特征值,与对照相比评价颅骨组织的载荷性及弹性性质
。
表
11
是分组1保存4个样本
12
个月的抗冲击水平检测结果,表
12
是分组6的检测结果
。
[0112]
表
11、
分组1保存液颅骨韧性检测结果
[0113]
编号样本信息
/
检测结果冲击韧性特征值
(j/cm2)1
检测样本
15.562
检测样本
24.793
检测样本
34.384
检测样本
44.11
[0114]
表
12、
分组6保存液颅骨韧性检测结果
[0115]
编号样本信息
/
检测结果冲击韧性特征值
(j/cm2)1
检测样本
14.882
检测样本
24.113
检测样本
33.974检测样本
43.44
[0116]
钙离子能够补充湿法保存中流失的钙质,降低脱钙率,维持钙平衡,对比低
ga
2+
保存液组
(
分组
6)
保存
12
个月的颅骨组织元素含量,保存的4份颅骨组织样本均呈现显著
ga
2+
流失现象
(
表
4)
,
ga
2+
流失易导致
ga
2+
失衡,易直接造成颅骨组织物理特性下降
(
表7和表
9)
,因此低
ga
2+
含量不利于颅骨组织长期保存
。
[0117]k+
含量过高可能激活细胞代谢,加速细胞代谢速率,造成细胞能量流失,不利于组织长期保存,颅骨组织细胞在其低温保存过程中,须确保维持较低的代谢速率,过高的代谢速率将不利于颅骨组织长期保存,对比两组k+
保存液组
(
分组1和分组
7)
保存
12
个月的颅骨组织元素含量检测结果,高k+
含量对保存的颅骨组织元素含量未呈现显著影响
(
表3和表
5)
,考虑到高浓度
k+
的保存液可能具有促进细胞代谢速率的作用,进而增强细胞能量消耗,过高的代谢速率引起其他因素的代谢连锁反应,当保存液中用于维持能量代谢的成分
(
如人血白蛋白
)
快速消耗殆尽,则最终导致颅骨保存质量和物理特性下降,不利于颅骨组织长期保存,因此,选择分组7的k+
浓度作为配制颅骨保存液的推荐浓度
。
[0118]
本发明对比了目前公开报道的颅骨组织湿法保存液与采用分组7保存液保存的4个样本元素组成及物理特性的差异,排除样本因年龄
、
日常接触环境
、
生活条件等诸多影响骨组织特性和状态的条件因素,使用分组7保存的颅骨材料,影响其特性的关键元素,如钙
、
氧及磷元素等维持骨量的关键化学元素含量均高于已报到的保存液,说明使用该保存液能够维持较低的脱钙率和化学元素流失率,抗压水平和冲击韧性检测结果显示,采用分组7的保存液保存的颅骨组织具有较高的抗冲击能力和冲击韧性特征值,说明使用分组7保存液能够有效保持颅骨特性,有利于提高回植的质量
。
[0119]
另外,人血白蛋白用于维持生物样本长期保存的细胞活性,考虑到生物样本保存具有长久性,且保存途中不会更换保存液或为保存组织补充能量成分,结合高浓度人血白蛋白未报到对细胞存在不利影响等依据,因此将7%人血白蛋白作为保存液推荐浓度
。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1