鸡肉中链霉素标准样品、制备方法及应用与流程
本发明属于分析化学领域,涉及一种兽药残留的自然基体标准样品的制备,具体地说,涉及一种鸡肉中链霉素残留基体冻干粉标准样品及其制备方法与应用。
背景技术:
链霉素(streptomycin)是在1944年从灰链霉菌的培养液中提取的抗菌素,分子式为C21H39N7O12,分子量为581,白色粉末,水溶性在pH值3至7下对热比较稳定,有盐酸盐和硫酸盐等产品。链霉素属于氨基糖甙碱性化合物,是一种抗生的有机碱,能有效地抵抗许多细菌,它与结核杆菌菌体核糖核酸蛋白体蛋白质结合,起到了干扰结核杆菌蛋白质合成的作用,从而杀灭或者抑制结核杆菌生长的作用,其作为饲料添加剂和治疗剂在农业、牧业和养殖业上广泛应用。链霉素对人体有一定的毒副作用。双氢链霉素(dihydrostreptomycin)是链霉素的衍生物,链霉素分子中链霉糖部分的醛基被还原成伯醇基后,就成为双氢链霉素,分子式为C21H41N7O12,分子量为583.44。其抗菌效能与链霉素大致相同,但对听觉神经的毒性比链霉素大,链霉素和双氢链霉素都是氨基糖甙类抗生素中重要的药物。在水产和畜牧养殖中,二者常被用来预防各种动物性疾病或被添加到饲料中促进动物生长发育。食品中如果残留有过量的链霉素或者双氢链霉素,会对人造成严重危害,如损害前庭神经和耳蜗神经,导致眩晕和听力减退,链霉素和双氢链霉素还具有潜在的致畸作用。
欧盟明确规定禁止使用该类药物作为家畜的促生长添加剂;美国FDA由于其毒副作用及容易产生耐药性,对动物源性食品中该类药物的残留也极为关注。2377/90/EEC(703/2007修订)规定动物性食品肌肉、脂肪、肝脏中链霉素最大残留限量MRL为500μg/kg,肾脏中为1000μg/kg,乳中为200μg/kg。食品法典委员会(CAC)规定动物性食品肌肉中链霉素的MRLs为0.5mg/kg,肝脏中的MRLs为0.5mg/kg,肾脏中的MRLs为1.0mg/kg。我国动物源性食品残留物质监控计划中链霉素与双氢链霉素均为禁药,在鳗鱼基质中要求方法检出限(以链霉素和双氢链霉素总量计)为10μg/kg。
在食品安全检测体系中,标准样品对整个检测质量控制体系起到核心作用。在国际上,一种兽药残留量的分析方法的建立需要经3种类型的样品测试:受控组织或液体、用药物强化至或接近最大容许水平(MRL)的样品和本身具有药物残留的组织样品,从而保证分析方法能具有一定的样品基质适用范围和重复性。欧盟对兽药残留分析方法与结果表达的法规(2002/657/EC)中明确指出了需要采用实物标准样品进行检测过程控制,可见实物标准样品在兽药残留检测中的具有十分重要的意义。
目前用于链霉素类药物残留检测的主要是纯标准品,检测质量控制主要是通过向样品中添加纯的标准品后进行检测分析,这种分析方法无法代表目标分析物在活体内真正存在的状态,不能真实地重现药物经过自然代谢后在动物体内的提取效率,无法反映方法的准确性。由于目标物和基体结合情形与真实检测样品不完全一致而导致提取、净化等处理结果与日常分析样本存在较大差异,从而影响结果的可靠性和有效性。另外,一般标准样品前期制备过程中添加有维生素C等抗氧化剂,导致标准样品在后期的相关药物残留检测分析等的应用过程中对实验结果造成干扰和影响。
技术实现要素:
为了解决现有技术中链霉素类药物残留检测不能真实地重现药物经过自然代谢后在动物体内的提取效率,无法反映方法的准确性,影响结果的可靠性和有效性,且存在抗氧化剂影响使用结果的技术问题,本发明的一个目的是提供鸡肉中链霉素标准样品的制备方法与应用。本发明的另一个目的是提供本方法制备的鸡肉中链霉素标准样品。
本发明为解决上述技术问题所采用的技术方案是:鸡肉中链霉素标准样品的制备方法,其特征在于,包括以下步骤:
A)、选择活鸡,人工饲喂含有链霉素的饲料,使鸡体内含有链霉素;
B)、给药结束后,宰杀、取鸡肌肉,搅碎,混匀制成肉糜,均质、真空冷冻干燥得到粗样;
C)、研磨步骤B所述粗样,过筛,得到鸡肉冻干粉标准样品;
D)、封装所述标准样品,冷藏保存;
E)、检验所述标准样品的均匀性和稳定性;
F)、对所述标准样品中的有链霉素含量进行定值。
所述步骤A中实验动物的选择,操作为:在养鸡场筛选个体健康、大小均一、均重1.5-2.5kg的鸡,雌雄随机,在20℃-25℃环境下隔离,每日上午8时喂食1次,驯养3日后待用。
所述步骤A中药物添加,操作为:称取0.2~2.4g链霉素,加入到2.0kg饲料中,搅拌均匀,即配制出链霉素浓度为0.1~1.2g/kg的饲料A。
所述步骤A中采用人工饲喂进行实验,操作为:每只鸡每日饲喂饲料A 50g,即投药剂量为2~40mg/kg体重;每日给药一次,连续给药3-5日。
所述步骤B中的宰杀时间为最后一次给药结束后3~5h。
所述步骤B中的真空冷冻干燥条件为:预冷冻阶段:-80℃--30℃,相应预冷时间0.5-10h;真空冷冻阶段:压力控制在0.01-1.0mbar,相应时间8-15h;干燥升华阶段:-10℃-30℃,相应时间2-10h。
所述步骤C过筛的目数为30~80目。
所述步骤D中所用瓶子为带有铝箔垫片的白色聚乙烯塑料瓶,每瓶装10g冻干粉,电磁感应封盖,2-8℃冷藏保存。
所述标准样品的链霉素含量为100μg/kg~2000μg/kg
本发明的显著优点是:
1)给鸡饲喂含有链霉素的饲料,选择适当时机,宰杀,取肌肉部分匀浆制成肉糜,冷冻干燥,过筛,分装密封包装;
2)均匀性检验、稳定性研究和协作定值检测,通过给药控制和采集时机的选择可获得预期含量的目标物结合状态与实际检测样品一致的含链霉素基体阳性材料;
3)本发明的产品可以在常温下运输,保质期长,目标物和基体结合情形与真实检测样品一致,标准样品为实物标准样品,均匀稳定,无防腐剂及抗氧化剂,易保存,用于链霉素类药物残留测试项目的能力验证、检测方法的验证、测试仪器的校准、测试结果的质量控制与考核。
附图说明
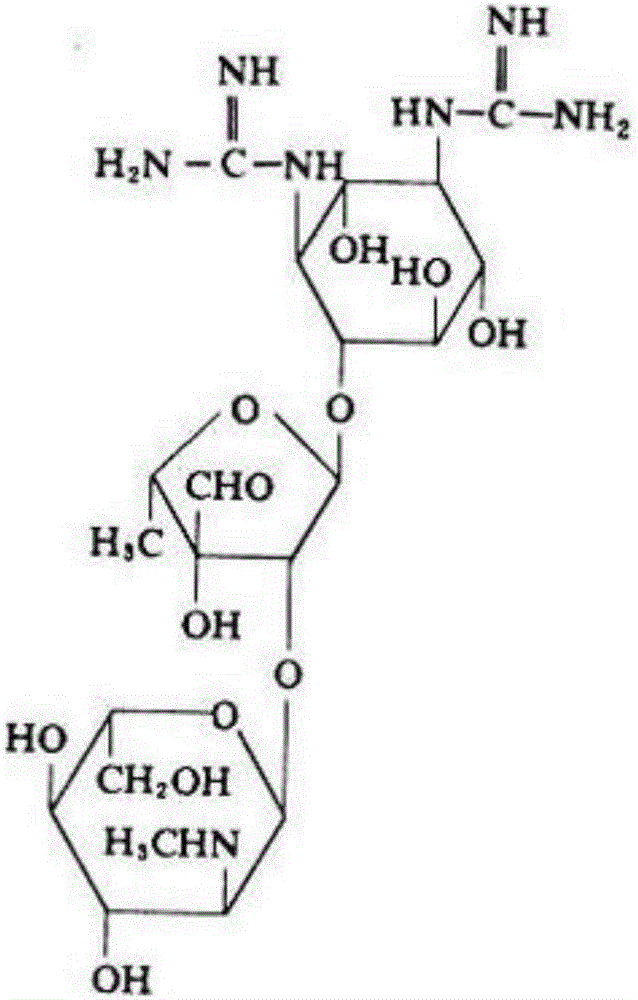
图1为链霉素的化学结构式。
图2为本发明的标准样品制备工艺流程图。
图3为本发明的标准样品的LC-MS谱图。
具体实施方式
如图2所示,本发明的鸡肉中链霉素标准样品的制备方法,包括以下步骤:A)药物喂养;B)取样、去杂质、匀浆;C)真空冷冻干燥;D)研磨、筛分、混样、封装;E)均匀性和稳定性检验;F)确定链霉素含量。
下面结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
实施例1
一种鸡肉中链霉素标准样品的制备方法,其具体步骤如下:
(1)实验动物的选择:在养鸡场筛选个体健康、大小均一、均重2kg的肉食白羽鸡,雌雄随机。在25℃环境下隔离,每日上午8时喂食1次,驯养3日后,从中挑选18只待用;
药物饲养:称取1.6g链霉素,加入到2.0kg饲料中,搅拌均匀后,喂食18只驯养后的鸡,每只鸡日均饲喂50g饲料,每日上午8时喂食1次。投药剂量为20mg/kg体重,连续投药3日;
(2)给药3日后,即最后一次给药结束3h后,宰杀后取鸡肌肉,搅碎,混匀制成肉糜;
(3)真空冷冻干燥:采用真空冷冻干燥机(CHRiST Epsilon 2-6D)进行冷冻干燥,物料厚度2cm,-50℃预冷冻6h,0.1mbar真空冷冻10h,-10℃-30℃快速升温干燥8h,直至完全干燥,得到链霉素阳性冻干粗粉;
(4)研磨、过筛:冻干粉用中药粉碎机粉碎,组织研磨机细磨,过30目筛,取筛下部分;
(5)分装及保存:用带有铝箔垫片的白色聚乙烯塑料瓶分装,每瓶装10g冻干粉,电磁感应封盖,2℃冷藏保存。
采用LC-MS检测实施例1制备的样品,结果如图3所示,证实标准样品中含有链霉素。
实施例2
本实施例中重复实施例1中的制备过程,不同的实验条件为:
1)实验动物选择体重为1.5kg;
2)称取链霉素0.2g;
3)三种药物投药剂量均为3.3mg/kg体重;
4)连续给药5日;
5)最后一次给药结束3h后宰杀;
6)-80℃预冷冻0.5h,0.01mbar真空冷冻8h,快速升温干燥2h;
7)过50目筛;
8)5℃冷藏保存。
实施例3
本实施例中重复实施例1中的制备过程,不同的实验条件为:
1)实验动物选择体重为2.5kg;
2)称取链霉素2.4g;
3)三种药物投药剂量均为24mg/kg体重;
4)连续给药4日;
5)最后一次给药结束4h后宰杀;
6)-30℃预冷冻10h,1.0mbar真空冷冻15h,快速升温干燥10h;
7)过80目筛;
8)8℃冷藏保存。
实施例4
对实施例1中样品进行均匀性与稳定性检验:
1.均匀性检验
采用单因素方差分析方法进行均匀性检验,随机抽取12瓶实例1制备的样品,每瓶样品平行测定2次。所有试料以随机次序在重复性条件下测试,即在同一实验室中由相同的人员使用相同的测试方法和仪器在较短时间内测试。
测试方法:称取0.5g样品,加4.5ml水还原15min,按GB/T 21323-2007动物组织中氨基糖苷类药物残留量的测定高效液相色谱-质谱/质谱法进行检测。
采用以下单因素方差分析进行均匀性评价。
抽取i个样品(i=1、2、3、…m),每个样品在重复条件下测试j次(j=1、2、3、…n)。
每个样品的测试平均值
全部样品测试的总平均值
测试总次数
样品间平方和均方
样品内平方和均方
自由度f1=m-1
f2=N-m
统计量
均匀性检测结果及评价见表1。
表1实例1制备的样品均匀性检测结果及统计分析
单位:μg/kg
以上结果可知:当α=0.05,f1=11,f2=12,查F分布表,F临界值为2.72,因F统计值(1.90)<F临界值2.72,表明样品内及样品间无显著性差异,说明样品是均匀的,能够满足质控等实验要求。
采用相同方法,验证实施例2、3制得的标准样品的均匀性,F比分别为2.05、2.20均小于F临界值2.72,表明实施例2、3制得的标准样品样品内及样品间无显著性差异,说明样品是均匀的,能够满足质控等实验要求。
2.稳定性检验
2.1长期稳定性检验
按照时间间隔前密后疏的抽样原则,分别按下列时间随机抽取用于稳定性测试的包装好的实施例1制备的样品:第0、2、4、6、9、12、18月。每次抽取3个样品进行测试。在全部稳定性测试中,所用人员、仪器、测试方法和实验室均与均匀性测试相同。结果及统计分析如表2所示。
用线性拟合模型评估标准样品的稳定性,以X代表时间,Y代表标准样品中目标药物的含量,斜率b1用下式计算:
斜率的估计值:
截距的估计值:
直线上每点的标准偏差公示:
与斜率相关的不确定度:
当|b1|<t0.95,n-2·s(b1),表明斜率变化不显著,即标准样品是稳定的。
表2样品长期稳定性检查及统计分析
单位:μg/kg
自由度为n-2和p=0.95(95%置信水平)的分布即t0.95,(n-2)=2.57,由于|b1|<t0.95,n-2·s(b1),故斜率不显著的,即未观测到不稳定性,验证实施例1制得的标准样品的稳定性良好。
2.2短期稳定性检验
短期稳定性检验:即考察标准样品在运输条件下的稳定性,采用快递方式运输标准样品,大部分地区3-4天都能收到样品,极个别的地方9天之内也能送达。运输时,将样品放置于隔热泡沫塑料箱中然后置冰块一起运输。运输时,将样品放置于隔热泡沫箱中然后置冰块一起运输。随机抽取冷藏保存的样品6瓶,用特快专递于8月中旬寄到新疆乌鲁木齐,到达乌鲁木齐后原封再寄回大连,同样方式随机抽取冷藏保存的样品6瓶,用特快专递于12月中旬寄到黑龙江漠河,到达漠河后原封再寄回大连。样品寄出到寄回所有时间为10d。对寄回的样品(运输后样品)采用GB/T 21323-2007方法进行检测,并与未经运输的样品(运输前样品)作比对分析实验。
用t检验法对运输前后样品的测定值进行一致性检验,检验公式为:
统计量t计算:
计算出t实验,与比较,如果t实验小于临界值,则认为该标准样品的特性量值没有发生显著性变化,否则认为有显著性差异。结果见表3。
表3样品短期稳定性检验结果及统计分析
从表3可以得出,t实验值均小于查表值(2.228),表明该标准样品的特性量值运输前后的测定值具有一致性。验证实施例1制得的标准样品的短期稳定性良好。
采用上述相同方法,验证实施例2、3制得的标准样品的稳定性,斜率均不显著,未观测到实施例2、3制得的标准样品不稳定性,结果表明实施例2、3制得的标准样品稳定性良好。
实施例5
标准样品中链霉素含量的定值:
八家实验室采用LC-MS/MS方法对实施例1制备的标准样品进行协同定值。对经过均匀性和稳定性检验合格的样品,随机抽取40瓶,分别分发到8家参加定值的实验室进行检测,结果见表4。8个实验室的定值数据采用夏皮罗-威尔克(Shapiro-Wilk)检验法考察其正态性。在近似符合正态性的前提下,再经Grubb’s法检验确认每个实验室数据是否存在异常值,用科克伦(Cochran)检验各实验室定值数据是否等精度,结果表明所有的数据均通过检验,各实验室测试精度一致。
表4合作定值实验室测试结果
单位:μg/kg
定值结果由标准值和不确定组成。对于多家实验室协作定值方式,标准值是多家实验室的总平均值。标准值的总不确定主要来源于定值结果的不确定度、样品不均匀性引起的不确定度、稳定性引起的不确定度。
假定各变量是独立的,与CRM特性值有关的不确定度可表示为:
其中uchar是指定值过程引入的不确定度,ubb是指样品不均匀性引入的不确定度,ults是指样品长期稳定性引入的不确定,usts是指样品短期稳定性引入的不确定度。
扩展不确定可由合成标准不确定度乘以包含因子,取k=2(置信区间95%),得扩展不确定:U=k×uCRM
通过统计分析,采用标准值±扩展不确定度的方式表示定值结果,最终确定实施例1中制备的标准样品:链霉素含量(630±33)μg/kg,k=2。
采用上述相同方法,对实施例2、3的标准样品的链霉素含量进行合作定值,采用标准值±扩展不确定度的方式表示,分别为(104±6)μg/kg,k=2、(810±45)μg/kg,k=2。
实施例6
鸡肉中链霉素标准样品的应用:
首先将实施例1制备的链霉素标准样品分发给相应实验室1-3及其人员,提供标准操作指导,然后进行实验,报告检测结果(μg/kg表示)及测量不确定度,用En值对各实验结果进行评价,En数由下式计算:
式中,
LAB和REF分别表示参试实验室和标准样品的测试结果;
ULAB和UREF分别表示贵实验室和标准样品测试结果的测量不确定度。
判断标准:|En|≤1,满意结果;En数的绝对值大于1时,为不满意结果,实验室应调查原因,采取进一步的纠正措施并重新进行。
如表5所示,实验室2和3|En|均小于1,为满意结果,说明实验室2和3具备相应的检测能力,实验室1的|En|大于1,为不满意或离群的结果,说明实验室1不具备相应的检测能力。对于报告不满意或离群结果的实验室,应查找原因,提出相应的整改措施,提高检测水平。结果显示制备的标准样品达到了试验要求,能够有效的保证链霉素残留检测盲样比对测试质量控制活动。
表5样品用于质量控制活动结果
进一步还可以将采用本发明的制备方法制备的标准样品用于检测方法的验证、测试仪器的校准、测试结果的质量考核等。
上述实施方式仅用来解释本发明,而不是对本发明进行限制,在本发明的精神和权利要求保护范围内,对本发明做出的任何修改和改变,都落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!