生物质提取物及其提取方法与流程
本申请要求于2014年4月21日递交的,序号为61/981,957的美国临时申请的优先权,其全部内容通过全文引用并入本申请。
技术领域
本发明一般涉及利用生物质的技术。更具体的,本发明提供能够有效的、大规模的捕获生物质(例如DDGS)的许多有价值组分的新方法,及其组合物和应用。
背景技术:
具有可溶物的干酒糟(DDGS)是酿酒过程的副产品。DDGS的传统来源是来自酿酒商。最近,美国生物乙醇产量从2000年的17亿加仑到2014年的150亿加仑的显著增长(http://ethanolrfa.org/pages/statistics)大大增加了DDGS的供应。目前,美国占全球生物乙醇产量的58%,令人惊讶的复合年增长率(CAGR)为16.8%。(http://ethanolrfa.org/pages/World-Fuel-Ethanol-Production)此外,美国能源部蓝图在2030年前需要400亿加仑的生物乙醇。
由于美国的主要原料是玉米,目前超过95%的DDGS由乙醇燃料厂生产。仅在美国和加拿大,每年就会生产3200万至3900万吨DDGS,这个数字预计将会继续增长。在加拿大和美国,超过75%的DDGS用作家畜饲料(“DDGS概述”,明尼苏达大学动物科学系http://www.ddgs.umn.edu/overview.htm。)
不同于由于含水量而具有四至五天保质期的维生素谷物(WDG),DDGS具有几乎无限的保质期,并且可以运输到任何市场,而不管其是否接近乙醇厂。来自乙醇工业,基于玉米的酒糟通常作为高蛋白质家畜饲料而销售。
DDGS的营养成分取决于所使用的谷物的来源和质量,以及产生DDGS的具体过程。在美国生产的大多数乙醇是由玉米制成。因为玉米包含约三分之二的淀粉,并且大多数淀粉在发酵期间转化为乙醇,DDGS的营养物(例如蛋白质、脂肪、纤维、灰分和磷)含量比玉米浓2至3倍。不同植物产生的DDGS在营养物质含量和质量上,可以存在大的变化。
除了玉米之外,小麦、大麦、黑麦和高粱(milo)也可用于酒精生产。来自小麦的DDGS比来自玉米和高粱的蒸馏产品具有高得多的蛋白质和低得多的脂肪含量。
一个主要的挑战是更好地利用由乙醇植物和酿酒商产生的大量生物质。为了降低燃料乙醇的生产成本,迫切需要来自生物精炼方法、新的和改进的DDGS和其它副产物的利用。虽然已经报道了从DDGS中提取蛋白质和生物柴油的尝试,但是在工业规模上,捕获DDGS中的许多其它有用组分尚未成功。
技术实现要素:
本发明部分是基于新的改进的技术的发现,该技术允许以有成本效益的商业规模,高效捕获生物质(例如DDGS)的有价值的活性成分。可以有效捕获的活性成分包括例如维生素、类黄酮、类胡萝卜素、生育酚和亲脂性酚类(lipophilic phenolics)、酚酸和核苷酸。本发明的提取物组合物以独特的比例存在一组活性成分,例如提高的生物利用度。
一方面,本发明一般涉及从生物质中提取一种或多种活性成分的方法。该方法包括:(a)使生物质与溶剂接触,其接触的条件和时间足以将一种或多种活性成分从生物质提取到溶剂中,从而产生残余生物质以及包含溶剂和提取的一种或多种活性成分的液相;(b)分离所述残余生物质和包含所述溶剂和一种或多种活性成分的液相;和(c)从液相中除去溶剂,得到包含一种或多种活性成分的浓缩混合物或基本上纯的形式的提取物组合物。
另一方面,本发明一般涉及包含通过本发明的方法提取的一种或多种活性成分的组合物。
再一方面,本发明一般涉及生物质提取物,其包含以重量计的:约0.1%至约10%的维生素;约0.1%至约10%的类黄酮;约0.1%至约10%的类胡萝卜素;约0.1%至约10%的生育酚;约0.1%至约30%的亲脂酚醛树脂和约0.1%至约30%的酚酸。
再一方面,本发明一般涉及从生物质中提取核苷酸的方法。该方法包括:(a)使生物质与碱性水溶液接触,其接触的条件和时间足以从生物质提取核酸,从而产生残余生物质和包含提取的核酸的碱性水相;(b)分离残余生物质和包含提取的核酸的碱性水相;(c)处理包含提取的核酸的碱性水相,以从水相中沉淀核酸;和(d)从水相中分离沉淀的核酸以产生包含核酸的提取物组合物。
再一方面,本发明一般涉及包含通过本发明的方法产生的核酸的组合物。
再一方面,本发明一般涉及包含通过本发明的方法产生的5'-核苷酸单磷酸单体的组合物。
再一方面,本发明一般涉及生物质提取物,其包含按重量计的:约0.1%至约50%的GMP;约0.1%至约50%的UMP;约0.1%至约50%的IMP;和约0.1%至约50%的CMP。
再一方面,本发明一般涉及包含通过本发明公开的方法产生的玉米醇溶蛋白的组合物。在某些实施例中,产生的玉米醇溶蛋白与来自商业来源或从玉米提取的玉米醇溶蛋白相似或基本相同。
附图说明
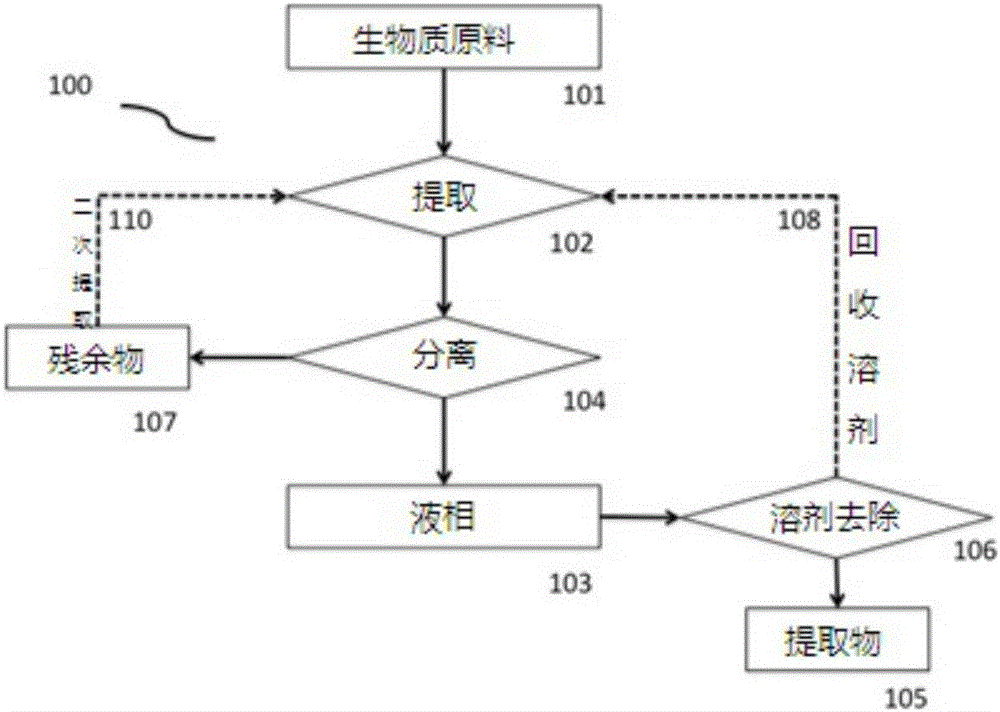
图1A示意性地描述了涉及生物质的提取以获得提取物组合物的本发明的示例性实施例;
图1B示意性地描述了涉及生物质的提取以获得提取物组合物的本发明的示例性实施例;
图2示意性地描述了涉及生物质的提取以获得提取物组合物的本发明的示例性实施例;
图3为DDGS盐水提取物的UV-VIS光谱;
图4为用生物活性剂(检测波长:300nm)对DDGS油进行HPLC分析;
图5为玉米醇溶蛋白的SDS-PAGE图像,泳道1:商业玉米醇溶蛋白;2:从DDGS提取的玉米醇溶蛋白样品;3:来自玉米的玉米醇溶蛋白;浓度:用样品缓冲液将30mg/mL玉米醇溶蛋白在70%EtOH中稀释至10mg/mL;
图6为核苷酸提取物的HPLC色谱图(检测波长为254nm);核苷酸的单个浓度为UMP,4.61±0.05mg/g;GMP,2.98±0.04mg/g;AMP,3.02±0.04mg/g;
图7为小鼠血浆中类胡萝卜素的吸收;
图8为小鼠血浆中γ-和α-生育酚的吸收;
图9为小鼠血浆中酚类的吸收。
定义
本申请所用的术语“生物质”广泛地指来自活的、或近期活的生物体的任何生物材料。生物质可以指植物或基于植物的材料,包括木质生物质和农业生物质。生物质的实例包括玉米糖浆、玉米油、糖蜜、青贮饲料、农业残余物(玉米秸秆、草、稻草、谷壳、甘蔗渣等)、酒糟湿谷物(DWG)、干酒糟(DDG),干酒糟(DDS),浓缩酒精可溶物(CDS),具有可溶物的干酒糟(DDGS)、改性DDGS、木质材料(木材或树皮、锯屑、木材斜纹和磨碎料)、杨树、柳树、桉树、柳枝稷、苜蓿、蓝藻、藻类、包括大型藻类等)。谷物淀粉的实例包括:全麦面粉、全燕麦/燕麦、全谷物玉米/玉米粉、糙米、全黑麦、全谷物大麦、全法兰、野生稻、荞麦、小黑麦、粟、藜麦、高粱、淀粉蔬菜包括:欧洲防风草、车前草马铃薯、南瓜、橡果南瓜、胡桃树、青豆。
示例性生物质还包括纤维素材料、木质纤维素材料、半纤维素材料、碳水化合物、果胶、淀粉、菊粉、果聚糖、葡聚糖、玉米、甘蔗、草、柳枝稷、高粱、高生物量高粱、竹、藻类和衍生自这些材料的材料。生物质还包括加工的或废的生物质,例如,经发酵产生醇或其他发酵产物后的生物质。
本申请所用的术语“发酵”是指使用微生物或微生物群,在适合微生物的培养基之中或之上,将有机分子转化成另一分子的过程。微生物可以有氧或厌氧生长。例如,“发酵可以指转化生物质中糖或其它分子以产生醇(例如乙醇、甲醇、丁醇);有机酸(例如柠檬酸、乙酸、衣康酸、乳酸、葡萄糖酸);酮(例如丙酮),氨基酸(例如谷氨酸)。因此,发酵包括酒精发酵。
发酵可以通过适合用于期望的发酵步骤的任何生物来实现,包括但不限于细菌、菌、细菌和原生生物。合适的发酵生物包括那些可以将单糖、二糖和三糖,特别是葡萄糖和麦芽糖或任何其它生物质衍生的分子直接或间接转化为所需发酵产物(例如乙醇、丁醇等)的生物。合适的发酵生物包括,例如,酵母或丝状真菌。酵母可以包括来自毕赤酵母属(Pichia)或酵母属(Saccharomyces)的菌株。在一些实施例中,酵母可以是酿酒酵母(Saccharomyces cerevisiae)。在一些实施例中,发酵由细菌实现。在一些实施例中,微生物(例如酵母或细菌)可以是经遗传修饰的微生物。
本申请所用的术语“预处理”是指导致生物质更易于用溶剂如醇或水溶液提取的,任何机械、热、生物化学或化学过程或其组合。
本申请在营养和营养成分的上下文中使用的术语“生物利用度”,可以定义为能够被吸收并可用于使用或储存的施用物质的比例。因此,生物利用度指通过正常途径消化,吸收和代谢的那部分营养物。(Srinivasan 2001“营养物的生物利用度:体外证明多种维生素-矿物质组合产品中营养物可用性的实用方法”,营养学报131(4Suppl):1349S-50S。)
本申请所用的术语“核酸”是指任何长度的聚合物,例如大于约2个碱基,大于约10个碱基,大于约100个碱基,大于约500个碱基,大于1,000个碱基或更多个由核苷酸组成的碱基,例如脱氧核糖核苷酸或核糖核苷酸。核酸可以以单链或双链形式存在。具有两条核酸互补链的双链核酸在本申请中可以称为“第一”和“第二”链或一些其他任意命名。
本申请所用的术语“核苷酸”是指核苷单磷酸,核酸(无论是DNA或RNA或其类似物)的亚单位,其包括磷酸基团、糖基和杂环碱基,以及这些亚单元的类似物。
具体实施方式
本发明提供了新的、改进的方法,该方法允许在商业规模上,有成本效益地、高效连续地捕获生物质(例如,DDGS)中的有价值的活性成分。可以有效捕获的活性成分包括,例如维生素,类黄酮,类胡萝卜素,生育酚和亲脂性酚类,酚酸,核苷酸和玉米醇溶蛋白。本发明还提供具有独特性质(例如营养价值和增强的生物利用度)的活性成分的新型组合物。另外,本发明通过生物质的高效和有成本效益的利用,降低了生物燃料生产的成本。
当以大规模(公斤级规模或更大)执行时,从DDGS中高效和有成本效益地回收活性成分遇到了许多挑战。在100公斤级或更大规模时,这些挑战可以变得更加显着。典型的困难包括起泡,固液相的分离,所需组分的低提取产率。例如,起泡是大规模提取中常见的困难,会大大降低提取效率并增加操作的成本。同时,固液分离是另一个常见的问题,其可能导致涉及复杂和耗时的分离程序,导致生产成本的增加。从基于谷物的DDGS中提取活性成分也存在独特的问题。例如,DDGS中的显着的油含量可能降低提取产率,并且由于需要重复提取而增加生产成本,因为在大规模提取过程中,非常需要通过提高提取效率来消除重复操作,这可以大大降低生产成本。可以通过选择最佳提取温度,时间,提取溶剂,应用酶将核酸分解成可提取单体,选择最佳固液分离方法来实现。
参照图1A,其描述了用于从生物质中提取活性成分的本发明的示例性实施方案的流程图(100)。将生物质原料(101)注入到提取容器中,并在溶剂与生物质的选择比例下,与溶剂(例如水或乙醇)混合。提取容器可以根据需要关闭或打开。提取(102)在设定的温度,压力和时间长度条件下进行。一旦认为提取完成,就进行分离步骤(104),由此分离固相和液相。固相或残余生物质(107)可以用新鲜溶剂(或多种溶剂)再提取,以进行进一步提取(110)。使液相(103)经历溶剂去除(106),产生粗提取物(105)。去除的溶剂(108),例如乙醇,可以回收用于提取(102)或其它目的。粗提取物(105)可以原样使用或可以进行进一步的处理和/或纯化程序。在提取核苷酸的情况下,酶被添加到水和DDGS的混合物中,以将核酸解聚成核苷酸,从而提供核苷酸提取物。
参照图2,其描述了用于从生物质中提取核酸和核苷酸的本发明的另一个示例性实施方案的流程图(100)。将生物质原料(201)注入到提取容器中,并在溶剂与生物质的选择比例下,与溶剂(例如碱性水溶液)混合。提取容器可以根据需要关闭或打开。提取(202)在设定的温度,压力和时间长度条件下进行。一旦认为提取完成,就进行分离步骤(204),由此分离固相和液相。固相或残余生物质(207)可以用新鲜溶剂(或多种溶剂)再提取,以进行进一步提取(212)。使液相(203)经历酸化和/或加入其它溶剂,以引起核酸沉淀,然后将其分离,得到粗提取物(205)。
一方面,本发明一般涉及从生物质中提取一种或多种活性成分的方法。该方法包括:使生物质与溶剂A接触,其接触条件和时间足以将一种或多种活性成分从生物质提取到溶剂A中,从而产生残余生物质I以及包含溶剂A和提取的一种或多种活性成分的液相;分离所述残余生物质I和包含溶剂A和提取的一种或多种活性成分的液相;以及从液相中除去溶剂A,得到包含一种或多种活性成分的浓缩混合物或基本上纯的形式的提取物组合物。
在某些优选的实施方案中,所述方法还包括:使残余生物质I与溶剂B接触,以将蛋白质提取到溶剂B中,从而产生残余生物质II以及包含溶剂B和蛋白质的液相;并分离残余生物质II和包含溶剂B和提取的蛋白质的液相;以及从液相中除去溶剂B,得到包含蛋白质的提取物组合物。
在某些优选的实施方案中,所述方法还包括:使残余生物质II与溶剂C和5'-磷酸二酯酶接触,以将核苷酸提取到溶剂中;并分离残余生物质II和包含溶剂C和提取的核苷酸的液相;以及从液相中除去溶剂C,得到包含核苷酸的提取物组合物。
再次参照图1B,本发明的示例性方法可包括以下步骤:(a)使生物质与溶剂(例如乙酸乙酯,乙醇或其组合)接触,其接触条件和时间足以将一种或多种活性成分从生物质提取到溶剂,从而产生残余生物质I以及包含溶剂和提取的一种或多种活性成分的液相;(b)分离所述残余生物质I和包含所述溶剂和一种或多种活性成分的液相;(c)从液相中除去溶剂,以得到包含一种或多种活性成分的浓缩混合物或基本上纯的形式的提取物组合物;(d)使残余生物质I与70%乙醇接触,以提取醇可溶性蛋白质(玉米醇溶蛋白);(e)分离残余生物质(其被称为残余生物质II)和包含溶剂和玉米醇溶蛋白的液相;(f)从液相中除去溶剂,得到包含玉米醇溶蛋白的提取物;(g)重复步骤(d)至步骤(f),以使玉米醇溶蛋白的产量最大化;(h)使残余生物质II与水和5'-磷酸二酯酶接触,以将核酸水解成可提取核苷酸;(i)分离残余生物质(其被称为废DDGS)和包含核苷酸和其它水溶性化合物的液相;(j)从液相中除去溶剂,得到富含核苷酸的馏分;以及(k)干燥废DDGS以产生废DDGS粉末。
任何合适的生物质原料都可以被使用。示例性生物质原料包括植物或基于植物的材料的发酵产物。在某些实施方案中,生物质原料是各种谷物(例如玉米、稻、小麦、大麦和黑麦)的发酵产物。在某些优选的实施方案中,生物质原料是DDGS。在某些优选的实施方案中,生物质原料是由基于玉米的乙醇发酵所产生的DDGS。
在某些实施方案中,生物质可以包括来自植物或基于植物材料的发酵产物碱性水提取的废生物质材料,例如来自谷物发酵产物碱性水提取的废生物质材料,所述谷物选自玉米、稻、小麦、大麦和黑麦。在某些实施方案中,所述生物质可包括由具有可溶物的干酒糟(DDGS)的碱性水提取产生的废生物质材料。
生物质可以是任何合适的形式,例如通常的具体形式的尺寸为约0.5μm至约10mm(例如,约0.5μm至约8mm,约0.5μm至约6mm,约0.5μm至约5mm,约0.5μm至约2mm,约0.5μm至约1mm,约1μm至约10mm,约10μm至约10mm,约50μm至约10mm,约1mm至约10mm)。
任何合适的溶剂(包括溶剂混合物)均可以用于提取。在某些实施方案中,使用醇作为溶剂。在某些优选实施方案中,使用乙醇作为溶剂。
在某些实施方案中,溶剂可以包括两种或更多种共溶剂,例如第一或主要共溶剂和第二或次要共溶剂。在某些实施方案中,使用乙醇作为主要共溶剂,并且还使用共溶剂(例如,另一种醇、水、丙酮、乙酸乙酯和己烷)。第一、主要共溶剂与第二、次要共溶剂的重量比可以是任何合适的比例,例如约5:1至约20:1(例如,约7:1至约20:1,约10:1至约20:1,约15:1至约20:1,约5:1至约10:1,约5:1至约12:1,约5:1至约15:1,约7:1至约12:1,约7:1至约10:1)。在某些优选的实施方案中,第一共溶剂是乙醇。
在某些实施方案中,溶剂A选自醇,水,丙酮,乙酸乙酯和己烷及其两种或更多种的组合;溶剂B选自水,乙醇,异丙醇和杂醇及其两种或更多种的组合;并且溶剂C选自水和盐水。
溶剂与生物质的重量比可以是任何合适的比例,例如约2:1至约15:1(例如,约2:1至约12:1,约2:1至约10:1,约5:1至约15:1,约5:1至约11:1,约5:1至约9:1,约7:1至约15:1,约7:1至约12:1,约7:1至约10:1,约7:1至约9:1)。
对于残余生物质和包含溶剂和一种或多种活性成分的液相的分离步骤,其可以通过任何合适的技术进行,例如通过过滤和/或离心。分离步骤可包括一轮过滤或离心或可包括两轮或多轮的过滤或离心或其组合。
一旦残余生物质从具有溶剂和一种或多种活性成分的液相中分离,从液相中除去溶剂,已得到一种或多种活性成分的粗提取物。
溶剂可以通过多种技术除去,例如通过蒸发、蒸馏、真空转移和过滤。蒸发可以在升高的温度和/或减压下进行。适合于溶剂去除的温度和压力可以根据溶剂的性质,生产的规模,所回收的溶剂是否被回收在提取中再利用等来选择。通常,蒸发可以在以下温度下有效地进行:约20℃至约100℃(例如,约30℃至约100℃,约40℃至约100℃,约50℃至约100℃,约60℃至约100℃,约20℃约100℃,约20℃至约100℃,约20℃至约100℃,约20℃至约100℃),在约大气压至约1mmHg的压力下进行。在某些实施方案中,从液相除去的溶剂被回收并用于提取步骤。
根据生物质的来源,可以根据本发明公开的方法提取多种化合物。优选地,所述一种或多种活性成分选自维生素、类黄酮、类胡萝卜素、生育酚和亲脂性酚类以及酚酸。
在某些实施方案中,可通过本发明的方法提取的所述维生素包括以下的一种或多种:维生素E、维生素B(例如维生素B1、B2、B3、B4、B6)、维生素D、维生素A。
在某些实施方案中,可通过本发明的方法提取的所述类黄酮包括以下中的一种或多种:花青素(包括无糖花色素苷糖苷和花青苷糖苷)。
在某些实施方案中,可以通过本发明的方法提取的所述类胡萝卜素包括以下中的一种或多种:β-胡萝卜素、叶黄素和玉米黄质。
在某些实施方案中,可通过本发明的方法提取的所述生育酚包括以下的一种或多种:α-生育酚、δ-生育酚和γ-生育酚。
在某些实施方案中,可通过本发明的方法提取的所述亲脂性酚类包括以下中的一种或多种:阿魏酸及其酯和香豆酸及其酯、咖啡酸及其酯,以及突触酸及其酯。
根据生物质的来源和特定的提取条件,活性成分的相对产率可能变化,其可以被用于控制所得提取物的组成。例如,基于玉米的DDGS类胡萝卜素含量通常高于基于小麦的DDGS。
本发明的方法能够有效回收活性成分。特定成分的实际回收率取决于诸如生物质来源,溶剂选择,与生物质的比率,温度和提取时间等因素。该方法可以设计为适于提取一种或多种特定活性成分或类别的化合物。
在某些实施方案中,维生素的回收产率为1%或更高,例如约20%至95%,优选约50%至95%,更优选约70%至约95%,最优选约90%至约100%。
在某些实施方案中,类胡萝卜素的回收产率为1%或更高,例如约20%至95%,优选约50%至95%,更优选约70%至约95%,以及最优选约90%至约100%。
在某些实施方案中,亲脂性酚类的回收产率为1%或更高,例如约20%至95%,优选约50%至95%,更优选约70%至约95%和最优选约90%至约100%。
该方法还可以设计为适于提取特定组合的活性成分或化合物类别。在某些实施方案中,例如,该方法实现维生素的回收产率为60%或更高,类胡萝卜素的收率为60%或更高,亲脂性酚类的收率为60%或更高。在某些实施方案中,该方法实现维生素的回收产率为60%或更高,类胡萝卜素的收率为60%或更高,亲脂性酚类的收率为60%或更高。在某些实施方案中,例如,该方法实现维生素的回收产率为90%或更高,类胡萝卜素的收率为90%或更高,以及亲脂酚醛树脂的收率为90%或更高。
本发明的方法可以包括例如为了使生物质更适合于特定的提取和/或分离技术的预处理步骤。例如,可以将生物质原料(例如DDGS)研磨至期望的颗粒状态,优选研磨至适合于高效和有效的提取,并适合过滤和/或离心分离的水平。其它预处理技术包括例如切割,研磨,压制,剪切和切碎。
应注意,对于某些应用,对所需组合物的提取产物进行重复(例如,第二或第三轮)提取、分离和溶剂移除可能是有益的。重复轮可以与前一轮相同。在一个或多个方面,重复轮也可以不同于前一轮,例如溶剂的选择和量,提取时间,残余生物质分离技术和溶剂的去除。
应注意,尽管该方法通常可以通过不同规模(例如,从约5Kg至约20Kg,从约20Kg至约200Kg,每批至少20Kg的生物质,每批至少200Kg生物质,每批至少1,000Kg生物质)的分批法进行,该方法也可以设计为连续法,连续或周期性地补充生物质原料,连续的提取,分离残余和/或去除溶剂。
在另一方面,本发明一般涉及一种组合物,该组合物包含通过本发明公开的方法提取的一种或多种活性成分。
根据生物质的来源,提取条件(例如,溶剂选择,溶剂与生物质的比率,提取温度和时间长度),分离方法和溶剂去除,生物质提取物的组成可能变化。因此,可以处理生物质提取物,以产生某些活性成分的组合物。
再一方面,本发明一般涉及生物质提取物,其包括以重量计:约0.01%至约20%的维生素;约0.01%至约20%的类黄酮;约0.01%至约20%的类胡萝卜素;约0.01%至约20%的生育酚;约0.01%至约30%的亲脂性酚类和约0.01%至约30%的酚酸。
在某些实施方案中,生物质提取物包含按重量计约0.01%至约20%(例如约0.01%至约20%,0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的维生素E和维生素B;约0.01%约20%(例如,约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的类黄酮花青素;约0.01%至约20%(例如约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的类胡萝卜素、β-胡萝卜素和叶黄素;约0.01%至约20%(例如,约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的生育酚:包括α-、δ-和γ-生育酚;和约0.01%至约20%(例如,约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的亲脂性酚类:阿魏酸酯和香豆酸酯。
在某些实施方案中,生物质提取物包含按重量计约0.01%至约20%(例如约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的维生素E和维生素B;约0.01%至约20%(例如,约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%%至约10%,约1.0%至约5.0%)的花青素;约0.01%至约20%(例如,约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的β-胡萝卜素和叶黄素;约0.01%至约20%(例如,约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的生育酚:包括α-、δ-和γ-生育酚;和约0.01%至约20%(例如,约0.1%至约20%,约1.0%至约20%,约0.01%至约10%,约0.01%至约5.0%,约0.1%至约10%,约1.0%至约5.0%)的阿魏酸酯和香豆酸酯。
在某些实施方案中,生物质提取物包含按重量计约0.5%至约20%(例如约1.0%至约20%,约5.0%至约20%,约0.5%至约10%,约0.5%至约5.0%,约1.0%至约5.0%)的维生素E和维生素B;约0.5%至约20%(例如,约1.0%至约20%,约5.0%至约20%,约0.5%至约10%,约0.5%至约5.0%,约1.0%至约5.0%)的花青素;约0.5%至约20%(例如,约1.0%至约20%,约5.0%至约20%,约0.5%至约10%,约0.5%至约5.0%,约1.0%至约5.0%)的β-胡萝卜素和叶黄素;约0.5%至约20%(例如,约1.0%至约20%,约5.0%至约20%,约0.5%至约10%,约0.5%至约5.0%,约1.0%至约5.0%)的生育酚:包括α-、δ-和γ-生育酚;和约0.5%至约20%(例如,约1.0%至约20%,约5.0%至约20%,约0.5%至约10%,约0.5%至约5.0%,约1.0%至约5.0%)的阿魏酸酯和香豆酸酯。
在某些实施方案中,生物质提取物包含按重量计的:约10%至约20%的维生素E和维生素B;约10%至约20%的花青素;约10%至约20%的β-胡萝卜素和叶黄素;约10%至约20%的生育酚:包括α-、δ-和γ-生育酚;和约10%至约20%的阿魏酸酯和香豆酸酯。
再一方面,本发明一般涉及从生物质中提取玉米醇溶蛋白的方法。
又一方面,本发明一般涉及包含通过本发明公开的方法产生的玉米醇溶蛋白的组合物。在某些实施方案中,本发明的组合物包含约1%至约90%(例如,约1%至约80%,约10%至约80%,约20%至约80%,约30%至约80%,约40%至约80%,约50%至约90%,约60%至约90%,约70%至约90%,约80%至约90%)的玉米醇溶蛋白。
又一方面,本发明一般涉及从生物质中提取核苷酸的方法。该方法包括:(a)使生物质与碱性水溶液接触,其接触条件和时间足以将核酸从生物质提取出来,从而产生残余生物质和包含提取的核酸的碱性水相;(b)分离所述残余生物质和包含提取的核酸的碱性水相;(c)处理包含提取的核酸的碱性水相,以从水相中沉淀核酸;和(d)从水相中分离沉淀的核酸,以得到包含核酸的提取物组合物。
可以使用任何合适的生物质原料。示例性生物质原料包括植物或基于植物的材料的发酵产物。在某些实施方案中,生物质原料是各种谷物(例如玉米,稻,小麦,大麦和黑麦)的发酵产物。在某些优选的实施方案中,生物质原料是DDGS。在某些优选的实施方案中,生物质原料是由基于玉米的乙醇发酵所产生的DDGS。
在某些实施方案中,生物质可以包括来自植物或基于植物材料的发酵产物的醇提取的废生物质材料,例如,来自谷物酒精发酵产物的醇提取的废生物质材料,所述谷物选自玉米,水稻,小麦,大麦和黑麦。在某些实施方案中,生物质可以包括由具有可溶物的干酒糟(DDGS)的醇提取所产生的废生物质材料。
生物质可以是任何合适的形式,例如通常的具体形式的尺寸为约0.5μm至约10mm(例如,约0.5μm至约8mm,约0.5μm至约6mm,约0.5μm至约5mm,约0.5μm至约2mm,约0.5μm至约1mm,约1μm至约10mm,约10μm至约10mm,约50μm至约10mm,约1mm至约10mm)。
碱性水溶液可以具有任何合适的大于7的pH,例如约8至约11。在某些实施方案中,碱性水溶液的pH为约8至约9.5(例如,约8.0,8.2,8.4,8.6,8.8,9.0,9.2,9.4)。在某些实施方案中,碱性水溶液的pH为约9.5至约11(例如,约9.6,9.8,10.0,10.2,10.4,10.6,10.8)。
碱性水溶液可以包含任何合适的溶质以实现所需的碱性条件。例如,溶质可以选自碱,诸如氨,碳酸钠,氢氧化钠和氢氧化钾。
碱性水溶液与生物质的重量比可以是任何合适的比例,例如约1:1至约20:1(例如,约1:1至约15:1,约1:1至约12:1,约1:1至约10:1,约1:1至约8:1,约2:1至约20:1,约5:1至约20:1,约8:1至约20:1,约10:1至约20:1,约5:1至约15:1,约5:1至约12:1,约5:1至约10:1,约7:1至约15:1,约7:1至约12:1,约7:1至约9:1)。
对于分离残余生物质和包含核酸的液相的步骤,其可以通过任何合适的技术进行,例如通过过滤和/或离心。分离步骤可包括一轮过滤或离心或可包括两轮或多轮的过滤或离心或其组合。
在某些实施方案中,分离残余的生物质和包含核酸的液相,是通过一轮或多轮过滤进行的。
在某些实施方案中,分离残余的生物质和包含核酸的液相,是通过一轮或多轮离心分离进行的。
随后处理包含核酸的碱性液相,使核酸从液相中沉淀,例如通过向碱性液相中加入一种或多种有机溶剂(例如乙醇,乙酸乙酯和己烷)。在某些实施方案中,将醇(例如乙醇)加入到碱性液相中以从液相中沉淀核酸。可以同时或依次加入共-有机溶剂(例如,另一种醇,乙酸乙酯和己烷)。
生物质提取物中回收的核酸可以包括RNA分子、DNA分子或两者,例如酵母RNA和酵母DNA。
本发明的方法能够从生物质原料中有效的回收核酸。特定核酸(RNA和DNA)的实际回收率取决于诸如生物质来源,溶剂pH,与生物质的比率,温度和提取时间等因素。该过程可以设计为适于某些核酸分子的提取,例如,优选回收酵母RNA分子。
在某些实施方案中,该方法实现了对提取前的生物质中的核酸的10%或更高的回收产率(例如,约10%或更高,约20%或更高,约30%或更高,约40%或更高,约50%或更高,约60%或更高,约70%或更高,约80%或更高,约90%或更高)。
本发明的方法可以包括预处理步骤,例如,以使生物质更适合于特定的提取和/或分离技术。例如,可以将生物质原料(例如DDGS)研磨至期望的颗粒状态,优选研磨至适合于高效和有效的提取,并适合过滤和/或离心分离的水平。其它预处理技术包括例如切割、研磨、压制、剪切和切碎。
在某些实施方案中,生物质在与碱性水溶液接触之前,经一种或多种有机溶剂预处理。
此外,通过碱性水溶液对残余生物质进行重复(例如,第二或第三轮)提取,分离和溶剂移除可能是有益的,得到所需组合物的提取产物。重复轮可以与前一轮相同。在一个或多个方面,重复轮也可以不同于前一轮,例如溶剂选择和量,提取时间,残余生物质分离技术和溶剂的去除。
应注意,尽管该方法通常可以通过不同规模(例如,每批至少5Kg的生物质,每批至少50Kg的生物质,每批至少500Kg生物质)的分批法进行,该方法可以设计为连续法,连续或周期性地补充生物质原料,连续的提取,分离残余和/或去除溶剂。
又一方面,本发明一般涉及一种组合物,该组合物包含通过本发明公开的方法产生的核酸。
在生物质提取物的某些实施方案中,所述组合物包含按重量计约0.1%至约90%(例如约0.1%至约80%,约10%至约80%,约20%至约80%,约30%至约80%,约40%至约80%,约50%至约90%,约60%至约90%,约70%至约90%,约80%至约90%)的酵母RNA。在生物质提取物的某些实施方案中,所述组合物还包含约0.1%至约60%(例如约10%至约60%,约20%至约60%,约30%至约60%,约40%至约60%,约50%至约60%,约0.1%至约50%,约0.1%至约40%,约0.1%至约30%,约0.1%至约20%,约0.1%至约10%,小于10%,小于5%)的酵母DNA。
在某些实施方案中,酵母RNA与酵母DNA的重量比为约5:1至约20:1(例如,约5:1至约15:1,约5:1至约12:1,约5:1至约10:1,约5:1至约8:1,约8:1至约20:1,约10:1至约20:1,约12:1至约20:1,约15:1至约20:1,约6:1至约12:1,约7:1至约10:1)。
核酸的粗提取物可经进一步处理,使之转化为核苷酸和/或根据需要进一步转化。
在某些实施方案中,本发明的方法进一步包括:酶水解分离的核酸以产生5'-核苷酸单磷酸(MP)单体的混合物,所述5'-核苷酸单磷酸(MP)单体选自GMP、UMP、AMP和CMP。
又一方面,本发明一般涉及一种组合物,该组合物包含通过本发明的方法产生的5'-核苷酸单磷酸单体。
又一方面,本发明一般涉及生物质提取物,其包含以重量计的:约0.1%至约50%的GMP;约0.1%至约50%的UMP;和约0.1%至约50%的CMP。
在某些实施方案中,产生的玉米醇溶蛋白与来自商业来源或提取自玉米的玉米醇溶蛋白相似或基本相同。
实施例
实施例1.从DDSG中提取核酸
从DDSG中提取核酸(方法1)
称量DDGS(100.0g)并将之置于蓝色盖帽瓶中。向固体中加入氯化钠溶液(8%,300mL),将混合物加热至90℃,保持2小时。将所得浆液快速冷却至10℃并过滤。用盐酸将滤液调节至pH2.5。将溶液在4℃冰箱保存12小时,以沉淀RNA。然后将溶液离心,用无水乙醇(50mL)洗涤沉淀两次。将残余物溶于去离子水(50mL)中并过滤。通过UV-VIS光谱测量滤液。结果显示于图3中,根据260nm处的吸光度值估算核酸浓度,并显示于表1中。
表1.酒糟生物质核酸含量估算
·根据260nm处的吸光度值估算(一个吸光度单位相当于40μg/mL.)
从DDSG中提取核酸(稀释法)
在烧瓶(250mL)中,加入水(180mL),氢氧化钠(2.0g)和DDGS(20g)。将所得浆液搅拌30分钟,用盐酸(6.0M)将pH调节至中性(7.0)再搅拌10分钟。然后将混合物加热至90℃10分钟,冷却至室温,然后在4℃冰箱中过夜。将浆液以3500RPM离心,并倾析上清液。将上清液用盐酸(6M)酸化至pH 2.50并在4℃下保持过夜。将所得混合物以6000RPM离心,将沉淀物合并,用乙醇(95%,10mL)洗涤三次。将固体(粗核酸)溶解在1升蒸馏水中。测量260nm处的吸光度为0.093。基于该值,DDGS中的RNA的百分比估算为0.020%。
从DDSG中提取RNA(盐水法)
在烧瓶(250mL)中,加入水(180mL),氯化钠(20g)和DDGS(20g)。然后将混合物加热至95℃2小时,冷却至室温,然后将其置于4℃过夜。将浆液以3500RPM离心,并倾析上清液。将上清液用盐酸(6M)酸化至pH 2.50并在4℃下保持过夜。将所得混合物以6000RPM离心,将沉淀物合并,用乙醇(95%,10mL)洗涤三次。将固体(粗核酸)溶解在1升蒸馏水中。测量260nm处的吸光度为0.295。基于该值,DDGS中的RNA的百分比估算为0.059%。
乙醇脱脂后从DDSG中提取RNA
在烧瓶(250mL)中加入乙醇(95%,100mL)和DDGS(20g),搅拌30分钟。将混合物过滤,将残余物置于烧瓶中,并与氯化钠(20g)和水(180mL)混合。然后将混合物加热至95℃2小时,冷却至室温,然后在4℃下保持过夜。将浆液以3500RPM离心,并倾析上清液。将上清液用盐酸(6M)酸化至pH 2.50并在4℃下保持过夜。将所得混合物以6000RPM离心,将沉淀物合并,用乙醇(95%,10mL)洗涤三次。将固体(粗核酸)溶解在1升蒸馏水中。测量260nm处的吸光度为0.320。基于该值,DDGS中的RNA的百分比估算为0.064%。
核酸至核苷酸的水解:将来自DDGS的RNA提取物(10mg,获取自先前工序的00106段)与水(10mL)和来自青霉菌(Penicilliumcitrinum)冻干粉末(DDGS核酸的重量的0.2%)的核酸酶P1混合。将混合物调节至pH5.0,并在60℃下加热8小时。将所得溶液在90℃加热15分钟以使核酸酶P1失活。将所得溶液进行HPLC分析(核苷酸),结果显示溶液中的GMP浓度为10mg/L,AMP的浓度为5.5mg/L。
实施例2.DDGS的连续提取(5kg级)至不同级分中(方法1)
在该实施例中,进行5kg级的DDGS的连续提取,包括:油(乙酸乙酯和乙醇1:1混合物)→玉米醇溶蛋白(70%乙醇)→核苷酸(水和5'磷酸二酯酶)->废DDGS,详情如本发明记载。
用生物活性物质提取油
向具有加热夹套的20L反应器中加入无水乙醇(7.5L)和乙酸乙酯(7.5L),并搅拌混合。向混合物中加入DDGS(5Kg)并从室温加热至60℃,约需45分钟。将混合物保持在60℃下,搅拌1小时并冷却。30分钟后,温度达到30℃。将混合物倾析并离心。通过旋转蒸发器将滤液中的溶剂回收(12.6L,84%),得到729.4克油状物。将残余物置于反应器中,并与乙酸乙酯和乙醇混合物(1:1,15L)混合。45分钟后将混合物加热至60℃,并在该温度下保持搅拌1小时。30分钟后将混合物冷却至30℃,倾析浆液并过滤。将来自滤液的溶剂回收(12.7L,85%),得到179.2g油状物。具有生物活性物质的油的总产率为908.6g(18.2%)。残余物将用于进一步提取。
分析:油溶液的HPLC在与光电二极管阵列检测器(PDA)(Waters 2996)和自动进样器(Waters 717plus)偶联的Waters 2695HPLC系统上进行。HPLC柱为250×4.6mm,5μmRP C18柱(Waters,Atlantis T3)。流动相由A(0.04%乙酸的去离子水溶液)和B(0.04%乙酸的甲醇溶液)组成。HPLC分离的梯度程序显示在表2中。
表2.色谱分离的梯度程序
酚酸(香草酸、咖啡酸、对香豆酸和阿魏酸),叶黄素和α-生育酚的鉴定是基于比较各化合物的保留时间和紫外吸光度。关键化合物的浓度为:香草酸8.74mg/100g油);咖啡酸,8.68mg/100g油;对-香豆酸,14.49mg/100g油;阿魏酸,16.38mg/100g油;叶黄素,31.62mg/100g油;α-生育酚,40.12mg/100g油。典型的HPLC指纹图如图4所示。
玉米醇溶蛋白
将具有生物活性物质(自上面)的油提取的残余物置于20L反应器中,并与70%乙醇(15L)混合并加热至60℃,需50分钟将温度升至60℃。将浆液搅拌1小时,35分钟后冷却至30℃。倾析浆液并离心。通过旋转蒸发器(12.4L,乙醇浓度75%)回收滤液中的溶剂。将残余物在真空中干燥12小时,得到348.4g固体。将残余物置于20L反应器中,并与70%乙醇(15L)混合。将混合物在50分钟内加热至60℃,并在该温度下保持搅拌1小时。将混合物在35分钟内冷却至30℃,然后倾析并离心。将滤液进行旋转蒸发以回收溶剂(12.4L,75%乙醇),在60℃真空烘箱中干燥10小时后得到203.5g固体。玉米醇溶蛋白的总产量为551.7g(11%)。
从DDGS提取的玉米醇溶蛋白与商业玉米醇溶蛋白及来自玉米的玉米醇溶蛋白表达谱的分析方法。玉米醇溶蛋白的电泳采用来自Bio-rad公司(Hercules,California,USA)的电泳仪进行。在Paraman的SDS-PAGE方法(Paraman,I.;Lamsal,B.P.,从玉米发酵副产物中回收和表征α-玉米醇溶蛋白。农业与食品化学杂志2011,59,3071.)之后,在SDS-Tris-甘氨酸缓冲液系统中用4%堆积凝胶和12%分离凝胶显示提取的玉米醇溶蛋白的分子量分布。简言之,通过样品缓冲液:pH7.0的125mM Tris-HCl,2%SDS,10%甘油,5%2-巯基乙醇和0.05%溴酚蓝将玉米醇溶蛋白溶液稀释至10g/L。将蛋白质溶液离心以除去沉淀,将15μL溶液加载到凝胶上。在200V下进行电泳60分钟。凝胶用0.1%考马斯亮蓝溶液染色。使用范围为10至200kDa的Bio-rad分子量标记(Hercules,California,USA)。玉米醇溶蛋白的选择性图像显示在图5中。从图5可以看出,DDGS玉米醇溶蛋白与商业玉米醇溶蛋白及来自玉米的玉米醇溶蛋白相当。
核苷酸
在20L反应器中,将来自玉米醇溶蛋白提取的残余物(自上面)与水(15L)混合,并加热至60℃,然后加入50g 5-磷酸二酯酶(来自青霉菌来源的核酸酶P1,50g)。将混合物在60℃下搅拌24小时,并在30分钟内冷却至40℃。将浆液以3000r/min离心5分钟。将滤液(约13升)再次过滤以除去少量的白色沉淀。将所得澄清滤液喷雾干燥。干燥过程约需12小时,得到核苷酸级分,淡黄色粉末288克(5.6%)。
核苷酸含量的分析:HPLC在与光电二极管阵列检测器(PDA)(Waters 2996)和自动进样器(Waters 717plus)偶联的Waters 2695HPLC系统上进行。固定相是HPLC柱,为250×4.6mm,5μmC18柱(Atlantis,Waters)。流动相A(K2HPO4,0.1M,pH=5.6)是通过将13.6g K2HPO4溶解在1000mL去离子水中,并用2M KOH溶液调节pH至5.6而制备。流动相B为100%甲醇。溶剂梯度序列示于表3中。核苷酸提取物的HPLC色谱图示于图6中。
表3.核苷酸HPLC分析梯度程序
废DDGS
用少量水洗涤来自核苷酸提取的残余物(自上面)。用于洗涤残余物的总水量为1.5L。将残余物置于烘箱中并在100℃下干燥2天,得到3.00Kg的废DDGS固体(产率60%)。
废DDGS的氨基酸谱的HPLC定量:氨基酸的HPLC分析遵循Waters的标准方法:AccQ·Tag。AccQ·Tag衍生化试剂盒和AccQ·Tag洗脱液A购自Waters(Milford,Massachusetts,USA)。流动相A由50mL AccQ·Tag洗脱液A浓缩物和500mL去离子水组成,流动相B为乙腈,流动相C为去离子水。水解产物通过0.45μm微过滤器过滤得到。衍生化程序遵循Waters:将70μL缓冲液和20μL衍生化试剂加入到10μL水解产物中。将混合物摇动15秒钟,然后在55℃下放入加热器中10分钟。
表4.氨基酸
总氨基酸:78.8mg/g废DDGS.
总之,产物产率显示在下表5中。
表5.DDGS炼油厂5公斤级产品的产量
实施例3.DDGS的提取(5kg级)(方法2)
核苷酸
向夹套反应器(20L)中加入水(17L)并以100rpm搅拌,然后加入DDGS(5kg)。混合物相当粘稠。加入DDGS后,通过热循环器将反应器加热至60℃,需要35分钟。向溶液中加入5'-磷酸二酯酶(来自青霉菌的核酸酶P1,50g),并搅拌24小时。将浆液离心,得到混浊滤液,将其再次离心,得到13.7L液体。对液体进行喷雾干燥,得到740克褐色粘稠固体,其为核苷酸级分。
玉米醇溶蛋白
向夹套反应器中加入乙醇(70%,15L)和来自上述操作的残余物,并在60℃下搅拌1小时。温度冷却至30℃后,将混合物从反应器中分出并离心分离残余物2和滤液。从滤液中蒸发挥发物后,在70℃下真空干燥10小时后,得到粘稠的固体,产量为297克玉米醇溶蛋白。重复该步骤,多得到213克固体。玉米醇溶蛋白的总产量为511g。
含生物活性物质的油
向夹套反应器(20L)中加入乙酸乙酯和乙醇(1:1)并搅拌。向混合物中加入残余物2并加热至60℃维持1小时。将反应混合物的温度冷却至30℃后,将混合物从反应器中分出并离心。收集滤液,并使用相同量的溶剂(20L),乙酸乙酯和乙醇(1:1)再次提取残余物,并过滤,得到残余物3和滤液。蒸发溶剂后,所得油级分产率为240g。
废DDGS
将残余物3真空干燥,得到3174g固体,其为废DDGS(深棕色)。
总共,提取5Kg DDGS,得到:
·3174克废DDGS(63.5%)
·240克油(4.8%)
·511g玉米醇溶蛋白(11%)
·740克核苷酸(14.8%)
产品的总重量为:4665克(回收率为93.3%)。
实施例4.从DDGS提取的植物化学成分的生物利用度研究
动物研究。三十六只雄性CD-1小鼠(22-24g)购自Charles River Labs(Wilmington,MA)。在研究之前,让小鼠在SPF设施中适应至少3天。在Cephrim Biosciences,Inc.(Woburn,MA)的机构动物护理和使用委员会(IACUC)批准的方案或指南下进行动物的饲养,处理和操作。在每个笼子中饲养三只小鼠。温度,湿度和光/黑暗循环良好地维持在68-76°F,40-60%相对湿度,具有12小时光/暗循环。允许小鼠自由获得水和食物。
在研究的第一天,将小鼠随机分为两组,即酒精提取物(AE,DDGS)组和油提取物(OE,DDGS)组。将每组小鼠进一步分成6个亚组,代表6个时间点(即0小时,0.5小时,1.0小时,3.0小时,7.0小时和24小时)。通过口服管饲法给每组小鼠两个提取物中的每一个,剂量为AE 2mL,OE 2mL。给药时间设定为零时间。通过心脏穿刺收集血液样品,并立即转移到一组肝素化管中。
在给药前立即收集在时间0小时的血样。在其余5个时间点的每个时间点,提取物给药后的时间-0.5hr,-1.0hr,-3.0hr,-7.0hr和-24hr,从每个亚组(n=3)收集血液样品。将所有血液样品在收集后置于冰上,并以14000rpm/min旋转。将顶部血浆转移到新的预标记的管中,并将样品储存在-70℃直到分析。
血浆中生育酚和类胡萝卜素的测定。将小鼠血浆(150μL)与600μL己烷混合,并以200rpm振荡10分钟。将混合物在14,000rpm离心6分钟。将上清液在氮气下蒸发至干,并用100μL甲醇替换。然后将提取物在14,000rpm离心5分钟,并注入HPLC。
生育酚的HPLC条件:在C30反相柱(250×4.6mm,5μm)上以1mL/min的流速分离化合物。使用甲醇作为流动相。将柱保持在6℃。总运行时间为35分钟。在荧光检测器中进行检测,激发波长292nm,发射波长336nm。
类胡萝卜素的HPLC条件:在DeveloshR水性C30反相柱(250×4.6mm,5μm)上以1mL/min的流速分离化合物。使用双溶剂梯度系统完成HPLC分离。流动相由A)甲醇:MTBE:1%乙酸铵(83:15:2,V/V/V)和B)甲醇:MTBE:1%乙酸铵(8:90:2,V/V/V)。将柱保持在16℃。总运行时间为36分钟(运行后5分钟)。在450nm检测。
血浆中酚类物质的测定。将小鼠血浆(200μL)与12μL10%抗坏血酸-40mM KH2PO4-0.1%EDTA,30μl 50mM磷酸钾(pH 7.4),350单位来自大肠杆菌的X-A型β-d-葡萄糖醛酸酶(Sigma Chemical Co,St.Louis,MO,USA)和6单位来自鲍鱼肠内的硫酸酯酶VIII型(Sigma Chemical Co,St.Louis,MO,USA)。将混合物在37℃下孵育45分钟。通过加入2mL乙酸乙酯,然后剧烈摇动20分钟并在4℃下以2000×g离心5分钟来终止反应。将上清液转移到干净的管中,并重复乙酸乙酯提取。将10μL的0.02%抗坏血酸:0.005%EDTA加入到合并的上清液部分中,并充分涡旋混合。然后将上清液在氮气下在室温下蒸发至干。将样品在100μL甲醇中重构,充分涡旋,超声处理10分钟,并离心(14,000rpm,5分钟)。
酚的HPLC条件:在Phenomenex C18苯基-己基柱(250×4.6mm,5μm)上以1mL/min的流速分离化合物。使用双溶剂梯度系统完成HPLC分离。流动相由A)水:乙酸:乙腈(89:2:9,v/v/v),加入10mM PBS(pH 3.4)及B)80%乙腈(v/v),加入1mM PBS(pH 5)组成。将柱保持在20℃。总运行时间为50分钟(运行后5分钟)。使用具有500和800mV的电位设置的ESA 5600CoulArrray电化学检测器实现检测。
生物利用度测试的结果在图7-9中显示。图7显示在胃输注7小时后发现小鼠血浆中类胡萝卜素的最大吸收。如图8所示,在胃输注3小时后发现小鼠血浆中γ-和α-生育酚的最大吸收,而在胃输注24小时后发现小鼠血浆中δ-生育三烯酚的最大吸收。图9显示在胃输注后0.5小时发现小鼠血浆中酚类物质的最大吸收。如在该小鼠研究中所证明的,DDGS中鉴定的植物化学物质是生物可利用的。
在本说明书和所附权利要求中,除非上下文另有明确规定,否则单数形式“一”,“一个”和“该”包括复数引用。除非另有定义,本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同的含义。除了所公开的特定顺序之外,本文所述的方法可以以逻辑上可能的任何顺序进行。
通过引用并入
本发明提出了对其他文档的引用和引证,例如专利,专利申请,专利出版物,期刊,书籍,论文,网页内容。所有这些文献为了所有目的通过引用整体并入本文。通过引用并入本文中但与本文中明确阐述的现有定义,陈述或其他公开材料相冲突的任何材料,仅被认为其未与本公开冲突的部分被并入。在冲突的情况下,冲突以有利于作为优选公开的本公开来解决。
等同
代表性实施例旨在帮助说明本发明,而且并非旨在,也不应解释为限制本发明的范围。实际上,除了本文所示和所述的那些之外,本发明的各种修改和其许多进一步的实施方案,对于本领域技术人员来说,根据本文献的全部内容,包括实施例和对科学和专利的参考文献。实施例包含可以在其各种实施方案及其等同物中适应于本发明的实践的重要的附加信息、示例和指导。
- 还没有人留言评论。精彩留言会获得点赞!