一种载药纳米金刚石复合物的制备方法及其用途与流程
本发明涉及肿瘤治疗领域,特别是涉及一种载药纳米金刚石复合物的制备方法及其用途。
背景技术:
纳米载药系统用于恶性肿瘤治疗具有广阔的前景,但在治疗过程中存在着肿瘤细胞耐药性导致肿瘤复发和转移的问题。最新研究发现,载药纳米金刚石(NDs)能有效克服耐药性、抑制肿瘤细胞的生长和转移。发表在《Science Translational Medicine》的研究表明,能泵出抗肿瘤药物的肿瘤细胞却无法将纳米金刚石转运出细胞外,因此可以帮助结合在纳米金刚石上的药物滞留在细胞内,这一结论无疑为克服耐药性、增加药物在肿瘤组织滞留提供了新策略。然而载药纳米金刚石在临床的应用却受限于其以被动靶向方式的递送。
Xin Wang等人研究了一种载表阿霉素纳米金刚石[见“ACS Nano”,8卷12151-12166页,(2014年)],该系统具有很好的抗耐药性,但利用EPR(enhanced permeability and retention;EPR)效应被动穿透肿瘤血管内皮细胞间隙靶向聚集在肿瘤组织,这一方式导致其肿瘤靶向效率不高。此外,该文献中报道的载药纳米金刚石只负载一种抗肿瘤药物,单一用药这一措施大大降低了疗效。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种载药纳米金刚石复合物的制备方法及其用途,用于解决现有技术中纳米金刚石载药单一、疗效较差等问题。
为实现上述目的及其他相关目的,本发明第一方面提供一种载药纳米金刚石复合物的制备方法,包括如下步骤:
1)将纳米金刚石与水混合,制得第一溶液。
2)将盐酸阿霉素与水混合,制得第二溶液。
3)将第一溶液与第二溶液混合,制得第三溶液。
4)将氢氧化钠水溶液加入到第三溶液中,反应完全;加入氢氧化钠,使反应处于碱性环境中,有利于提高药物在金刚石表面的物理吸附,增加载药量。
5)将反应液离心,去掉上清液,所得沉淀即为阿霉素-纳米金刚石复合物;
6)将阿霉素-纳米金刚石复合物与水混合,制得第四溶液。
7)将全反式维甲酸与第四溶液混合,再加入异丙醇或二甲亚砜进行反应,制得第五溶液;
8)将第五溶液离心,收集沉淀,制得所述载药纳米金刚石复合物,即ATRA-DOX-NDs复合物。
进一步地,步骤1)中,所述第一溶液中纳米金刚石的浓度为2-10mg/mL,所述水优选为去离子水。
进一步地,步骤2)中,所述第二溶液中盐酸阿霉素的浓度为1-2.5mg/mL。
进一步地,步骤3)中,第一溶液中纳米金刚石与第二溶液中盐酸阿霉素的质量比为10:(1-5)。
进一步地,步骤4)中,加入氢氧化钠水溶液调至反应液的pH为12-13.6。
进一步地,步骤6)中,所述第四溶液中阿霉素-纳米金刚石复合物的浓度为2.5-10mg/mL。
进一步地,步骤7)中,全反式维甲酸与第四溶液中阿霉素-纳米金刚石复合物的质量之比为(1-5):15。
进一步地,步骤7)中,每mL第五溶液中加入0.2-1.0mL异丙醇或二甲亚砜。异丙醇或二甲亚砜可增加全反式维甲酸在水溶液中的溶解度。其作用是溶解全反式维甲酸,全反式维甲酸的加入量会直接影响异丙醇的加入量。异丙醇或二甲亚砜的加入量以刚好溶解完全反式维甲酸为宜,如果加入的异丙醇或二甲亚砜过多,阿霉素-金刚石将会从溶液中析出来,如果加入的异丙醇量过少,那么全反式维甲酸部分没有溶解,进而会影响载药量。因此,异丙醇或二甲亚砜的加入量存在一个临界点,多加或少加都会带来负面影响。
本发明第二方面提供上述方法制得的载药纳米金刚石复合物。
本发明第三方面提供上述载药纳米金刚石复合物在制备靶向治疗肿瘤药物中的用途。
进一步地,先对肿瘤部位进行超声辐照,再尾静脉注射载药纳米金刚石复合物溶液,完成给药后,再次超声辐照肿瘤部位。通过超声辐照肿瘤部位,瞬时增大肿瘤血管内皮细胞间隙和对纳米载药系统定向推移的作用,实现该系统主动穿透肿瘤血管内皮细胞间隙,靶向聚集在肿瘤组织。
进一步地,两次超声辐照的超声频率为0.5-1.5MHz,超声强度为0.10-0.60W/cm2,超声时间为1-10min。
本发明第四方面提供一种载药纳米金刚石复合物溶液,所述复合物溶液包括上述载药纳米金刚石复合物和水,用于动物实验中的载药纳米金刚石复合物溶液浓度为每kg动物体重中盐酸阿霉素的剂量为5-10mg。即是说,按照每kg生物体重注射5-10mg盐酸阿霉素的浓度注射对应的载药纳米金刚石复合物溶液。
如上所述,本发明的一种载药纳米金刚石复合物的制备方法,具有以下有益效果:本发明解决了现有纳米金刚石载药单一、疗效欠佳等问题,本发明的载药纳米金刚石复合物溶液,结合超声辐照,提高了载药纳米金刚石在肿瘤部位的聚集;两种药物的联合使用以及超声的促进作用,明显抑制了肿瘤的生长和转移,延长了荷瘤鼠等生物体的寿命。
附图说明
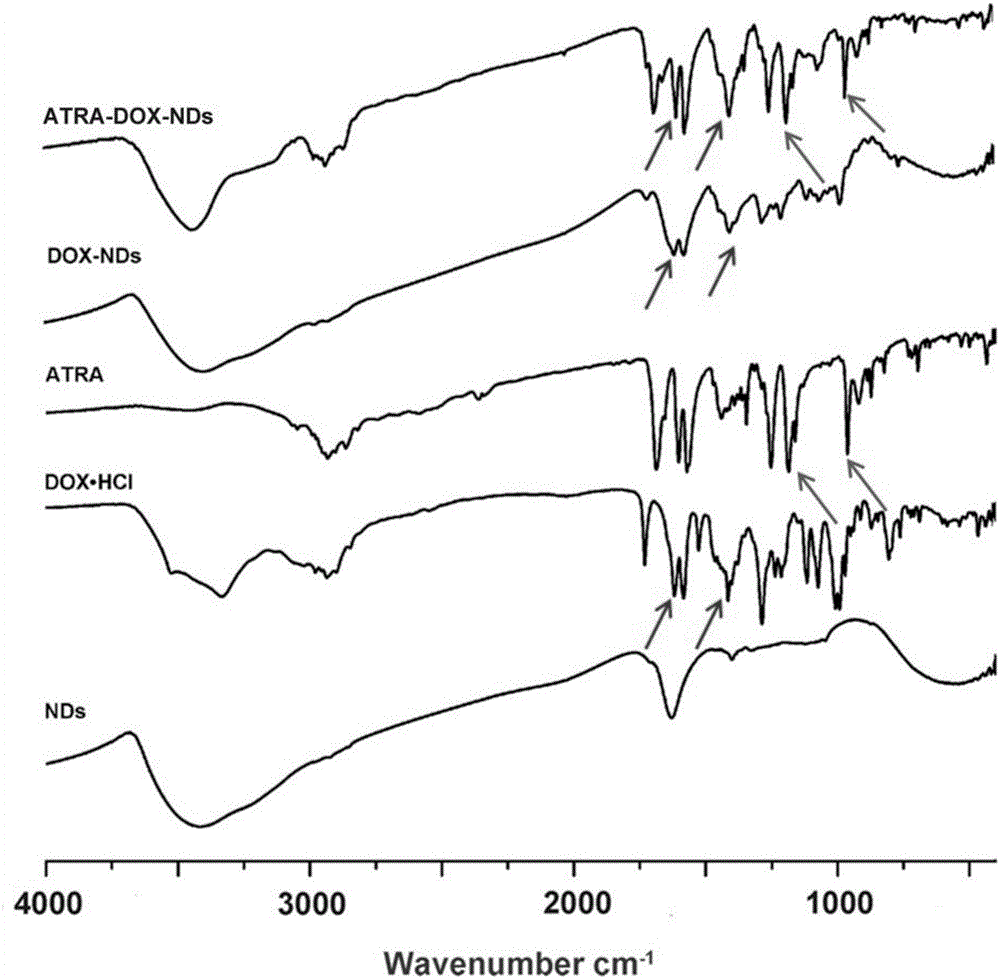
图1显示为本发明实施例的载药纳米金刚石的红外图。
图2显示为本发明实施例的载药纳米金刚石的粒径分布图。
图3显示为本发明实施例的药物在肿瘤细胞内的分布图。
图4显示为荷瘤鼠的死亡曲线图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
实施例1
一种载药纳米金刚石复合物的制备方法,包括如下步骤:1)取10mg纳米金刚石(简称为NDs),加入5ml去离子水,在常温常压下,使用50w超声分散约0.5h,得到浅棕色澄清透亮溶液,即第一溶液。
2)称取2mg盐酸阿霉素,用2ml去离子水配置为溶液,反应避光,超声助溶至溶液澄清透亮,得到第二溶液。
3)常温、磁力搅拌下,将第二溶液加入第一溶液中,制得第三溶液。
4)取0.02mol/l的NaOH溶液加入到第三溶液中调至溶液pH=12,常温、磁力搅拌下反应12小时。
5)反应溶液离心后,吸去上清液,得到12mg沉淀,即为阿霉素-纳米金刚石复合物。
6)将上述阿霉素-纳米金刚石复合物用2ml去离子水配置为溶液,反应避光,超声助溶至溶液澄清透亮,得到第四溶液。
7)称取4mgATRA(即全反式维甲酸)并与第四溶液混合,再加入2mL异丙醇,常温、磁力搅拌下反应12小时,制得第五溶液。
8)将第五溶液离心,收集沉淀,得到载药纳米金刚石复合物,即ATRA-DOX-NDs。
采用上述载药纳米金刚石复合物治疗肿瘤的具体方法如下:
a)将低强度聚焦超声定位辐照裸鼠肿瘤部位,超声频率为0.5MHz,超声强度为0.10W/cm2,超声时间为1min。
b)通过裸鼠尾静脉注射ATRA-DOX-NDs溶液(DOX的浓度为5mg/kg体重,即按照每kg动物体重注射5mgDOX的浓度注射对应的ATRA-DOX-NDs溶液)。
c)完成给药后,超声再次定位辐照裸鼠肿瘤部位,超声频率为0.5MHz,超声强度为0.10W/cm2,超声时间为1min。
实施例2
一种载药纳米金刚石复合物的制备方法,包括如下步骤:1)取10mg纳米金刚石(简称为NDs),加入2ml去离子水,在常温常压下,使用100w超声分散约1.0h,得到浅棕色澄清透亮溶液,即第一溶液。
2)称取4mg盐酸阿霉素,用2ml去离子水配置为溶液,反应避光,超声助溶至溶液澄清透亮,得到第二溶液。
3)常温、磁力搅拌下,将第二溶液加入第一溶液中,制得第三溶液。
4)取0.02mol/L的NaOH溶液加入到第三溶液调至溶液pH=13.0,常温、磁力搅拌下反应12小时。
5)反应溶液离心后,吸去上清液,得到14mg沉淀,即为阿霉素-纳米金刚石复合物。
6)将上述阿霉素-纳米金刚石复合物用2ml去离子水配置为溶液,反应避光,超声助溶至溶液澄清透亮,得到第四溶液。
7)称取2.5mgATRA并与第四溶液混合,再加入1mL二甲亚砜,常温、磁力搅拌下反应12小时,制得第五溶液。
8)将第五溶液离心,收集沉淀,得到载药纳米金刚石复合物,即ATRA-DOX-NDs。
采用上述载药纳米金刚石复合物治疗肿瘤的具体方法如下:
a)将低强度聚焦超声定位辐照裸鼠肿瘤部位,超声频率为1.0MHz,超声强度为0.30W/cm2,超声时间为5min。
b)通过裸鼠尾静脉注射ATRA-DOX-NDs溶液(DOX的浓度为8mg/kg体重)。
c)完成给药后,超声再次定位辐照裸鼠肿瘤部位,超声频率为1.0MHz,超声强度为0.30W/cm2,超声时间为5min。
实施例3
一种载药纳米金刚石复合物的制备方法,包括如下步骤:
1)取10mg纳米金刚石(简称为NDs),加入1ml去离子水,在常温常压下,使用150w超声分散约1.5h,得到浅棕色澄清透亮溶液,即第一溶液。
2)称取5mg盐酸阿霉素,用2ml去离子水配置为溶液,反应避光,超声助溶至溶液澄清透亮,得到第二溶液。
3)常温、磁力搅拌下,将第二溶液加入第一溶液中,制得第三溶液。
4)取0.02mol/L的NaOH水溶液加入到第三溶液调至溶液pH=13.6,常温、磁力搅拌下反应12小时。
5)反应溶液离心后,吸去上清液,得到15mg沉淀,即为阿霉素-纳米金刚石复合物。
6)将上述阿霉素-纳米金刚石复合物用2ml去离子水配置为溶液,反应避光,超声助溶至溶液澄清透亮,得到第四溶液。
7)称取1mgATRA并与第四溶液混合,再加入0.4mL异丙醇,常温、磁力搅拌下反应12小时,制得第五溶液。
8)将第五溶液离心,收集沉淀,得到载药纳米金刚石复合物,即ATRA-DOX-NDs。
采用上述载药纳米金刚石复合物治疗肿瘤的具体方法如下:
a)将低强度聚焦超声定位辐照裸鼠肿瘤部位,超声频率为1.5MHz,超声强度为0.60W/cm2,超声时间为10min。
b)通过裸鼠尾静脉注射ATRA-DOX-NDs溶液(DOX的浓度为10mg/kg体重)。
c)完成给药后,超声再次定位辐照裸鼠肿瘤部位,超声频率为1.5MHz,超声强度为0.60W/cm2,超声时间为10min。
对实施例1制得的药品在红外谱图、粒径分布、药物在细胞内的分布情况、治疗效果等方面进行实验观察,实验结果如下:
图1中,NDs:纳米金刚石;DOX·HCl:盐酸阿霉素;ATRA:全反式维甲酸;DOX-NDs:阿霉素-纳米金刚石;ATRA-DOX-NDs:全反式维甲酸-阿霉素-纳米金刚石。
关于图1中红外谱图的图解如下:通过对比纳米金刚石、盐酸阿霉素、全反式维甲酸、阿霉素-纳米金刚石、全反式维甲酸-阿霉素-纳米金刚石的红外谱图,能够明显看出在全反式维甲酸-阿霉素-纳米金刚石的谱图中出现了阿霉素和全反式维甲酸的特征峰,表明成功负载阿霉素和全反式维甲酸。
从图2的粒径分布图可以看出,全反式维甲酸-阿霉素-纳米金刚石的粒径大小在80纳米左右,粒径较小,分布较窄,有利于体内的靶向分布。
图3为激光共聚焦图,即药物在肿瘤细胞内的分布图,图解如下:全反式维甲酸-阿霉素-纳米金刚石在与癌细胞作用4个小时后,药物明显进入细胞核,表示药物在细胞内进行了有效释放。
本发明选择荷瘤鼠进行实验,通过裸鼠尾静脉分别注射DOX-NDs、ATRA-DOX-NDs溶液,观察上述两种药物对荷瘤鼠肿瘤的治疗效果。
采用Ulstrasound+ATRA-DOX-NDs治疗荷瘤鼠肿瘤的具体方法如下:
a)将低强度聚焦超声定位辐照裸鼠肿瘤部位,超声频率为0.5MHz,超声强度为0.10W/cm2,超声时间为5min。
b)通过裸鼠尾静脉注射ATRA-DOX-NDs溶液(DOX的浓度为5mg/kg体重,即按照每kg动物体重注射5mgDOX)。
c)完成给药后,超声再次定位辐照裸鼠肿瘤部位,超声频率为0.5MHz,超声强度为0.10W/cm2,超声时间为5min。
图4为荷瘤鼠的死亡曲线图,图中,从左向右依次为control:空白对照组、DOX-NDs:阿霉素-纳米金刚石组、ATRA-DOX-NDs:全反式维甲酸-阿霉素-纳米金刚石组、Ulstrasound+ATRA-DOX-NDs:超声+全反式维甲酸-阿霉素-纳米金刚石组,各组溶液中阿霉素的注射浓度为5mg/kg体重,通过对比可以看出,超声+全反式维甲酸-阿霉素-纳米金刚石组能够明显延长动物死亡时间,展示出优良的疗效。
实施例2和实施例3的实验结果与实施例1类似。
综上所述,本发明解决了现有纳米金刚石载药单一、疗效欠佳等问题,通过联合用药,达到协同增效的作用,本发明的载药纳米金刚石复合物溶液结合超声辐照,提高了载药纳米金刚石在肿瘤部位的聚集;两种药物的联合使用以及超声的促进作用,明显抑制了肿瘤的生长和转移,延长了荷瘤鼠等生物体的寿命。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!