利用噻吩并三唑并二氮杂*化合物治疗急性髓细胞白血病和/或急性淋巴细胞性白血病的方法与流程
本公开描述了利用噻吩并三唑并二氮杂
背景技术:
下文所述的式(1)的化合物已经显示出可抑制乙酰化的组蛋白h4与包含串联的溴结构域(brd)的转录调节子家族(称为bet(溴结构域和额外末端)蛋白,包括brd2、brd3和brd4)的结合。参见美国专利申请公开no.2010/0286127a1,其全文以引用的方式并入本文。denis,g.v.在文献“bromodomaincoactivatorsincancer,obesity,type2diabetes,andinflammation,”discovmed2010;10:489-499(该文献的全部内容以引用方式并入本文)中报道了如下内容:bet蛋白作为增殖和分化的主要的表观遗传调节子而出现,并且还与倾向于血脂异常或脂肪生成不当调节、心血管病和2型糖尿病的升高的炎症性质和风险、以及自体免疫疾病(例如类风湿性关节炎和系统性红斑狼疮)的易感性增加有关。因此,式(ii)所示的化合物可以用于治疗多种癌症、心血管疾病、2型糖尿病和自体免疫失调(例如类风湿性关节炎和系统性红斑狼疮)。
技术实现要素:
在一些实施方案中,本公开提供了使用本文所述的组合物治疗急性髓细胞白血病、急性淋巴细胞性白血病、慢性急性髓细胞白血病、高风险脊髓发育不良综合征和/或伴随急性髓细胞白血病的高风险脊髓发育不良综合征(称为hr-mds/aml)。
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml的方法,其包括:向需要的患者施用药学上可接受量的组合物,该组合物包含根据本文第iii、iv、v和vi部分中所述的任意组合物的固体分散体。在一些实施方案中,本公开提供了治疗方法,其中本文第iii、iv、v和vi中所述的组合物形成为固体分散体。
在一些实施方案中,本公开提供了治疗急性髓细胞白血病的方法,其中所述急性髓细胞白血病可以是混合型谱系白血病(mll)融合阳性(fusionpositive)、正jak2突变型真性红细胞增多症或骨髓增生异常综合征。在一些实施方案中,本公开提供了治疗急性髓性白血病的方法,其中所述急性髓细胞性白血病可以是急性嗜碱性白血病、伴有骨髓纤维化的急性全骨髓增殖症或髓细胞样肉瘤。在一些实施方案中,本公开提供了治疗急性髓细胞白血病的方法,其中所述急性髓细胞白血病可以是急性成髓细胞白血病(最小分化)、急性成髓细胞白血病(未成熟)、急性成髓细胞白血病(伴随粒细胞成熟)、急性早幼粒细胞白血病、急性骨髓单核细胞性白血病、伴随骨髓嗜酸性粒细胞增多的骨髓单核细胞性白血病、急性单核母细胞白血病、急性单核细胞白血病、急性红细胞性白血病或急性巨核细胞白血病。在一些实施方案中,本公开提供了治疗急性髓细胞白血病的方法,其中所述急性髓细胞白血病可以是伴随复发性遗传异常的急性髓细胞白血病、伴随多向性的急性髓细胞白血病或治疗相关的急性髓性白血病。在一些实施方案中,伴随复发性遗传异常的急性髓细胞白血病是具有复发性遗传异常的急性髓细胞白血病,其是具有t(8;21)(q22;q22)的急性髓细胞白血病、具有inv(16)(p13q22)或t(16;16)(p13;q22)的急性髓细胞白血病、具有t(15;17)(q22;q12)的急性髓细胞白血病或者具有11q23异常的急性髓细胞性白血病。在一些实施方案中,治疗相关的急性髓细胞白血病是烷化剂相关的急性髓细胞白血病或拓扑异构酶ii抑制剂相关的急性髓细胞白血病。
在一些实施方案中,本公开提供了治疗急性淋巴细胞性白血病的方法,其中所述急性淋巴细胞性白血病可以分类为all-l1。在其他实施方案中,急性淋巴细胞性白血病可以分类为all-l2。在其他实施方案中,急性淋巴细胞性白血病可以分类为all-l3。在一些实施方案中,急性淋巴细胞性白血病可以分类为前体b急性淋巴细胞性白血病或前b细胞。在其他实施方案中,急性淋巴细胞性白血病可以分类为前体t急性成淋巴细胞白血病或前t细胞。在一些实施方案中,前体b急性淋巴细胞性白血病可以具有细胞遗传亚型t(12;21)(p12,q22)tel/aml-1;t(1;19)(q23;p13)pbx/e2a;t(9;22)(q34;q11)ablibcr;或t(v,11)(v;q23)v/mll。在一些实施方案中,急性淋巴细胞性白血病是伯基特氏白血病。在一些实施方案中,急性淋巴细胞性白血病是双表型急性白血病。
在一些实施方案中,本公开提供了治疗慢性急性髓性白血病的方法,其中慢性急性髓性白血病处于慢性期。在其他实施方案中,慢性急性髓性白血病处于加速期。在另一个实施方案中,慢性急性髓性白血病是爆发急变期。
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml的方法,其包括下列步骤:施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了利用下式(1)的噻吩并三唑并二氮杂
其中r1为具有1至4个碳的烷基;r2为氢原子、卤素原子、或任选地被卤素原子或羟基取代的具有1至4个碳的烷基;r3为:卤素原子,任选地被卤素原子、具有1至4个碳的烷基、具有1至4个碳的烷氧基、或氰基取代的苯基,-nr5-(ch2)m-r6,其中r5为氢原子、或具有1至4个碳的烷基,m为0至4的整数,并且r6为任选地被卤素原子取代的苯基或吡啶基,或-nr7-co-(ch2)n-r8,其中r7为氢原子或具有1至4个碳的烷基,n为0至2的整数,并且r8为任选地被卤素原子取代的苯基或吡啶基;并且r4为:-(ch2)a-co-nh-r9,其中a为1至4的整数,并且r9为具有1至4个碳的烷基,具有1至4个碳的羟烷基,具有1至4个碳的烷氧基,或任选地被具有1至4个碳的烷基、具有1至4个碳的烷氧基、氨基或羟基取代的苯基或吡啶基,或-(ch2)b-coor10,其中b为1至4的整数,并且r10为具有1至4个碳的烷基。
在一些施方案中,式(i)选自式(ia)、其药学可接受的盐或其溶剂化物以及药学可接受的聚合物:
其中,x为卤素,r1为c1-c4烷基,r2为c1-c4烷基,a为1至4的整数,r3为c1-c4烷基、c1-c4羟烷基、c1-c4烷氧基、任选地具有取代基的苯基、或任选地具有取代基的杂芳基。在一个这样的实施方案中,将噻吩并三唑并二氮杂
在一个实施方案中,式(1a)选自由以下化合物构成的组:(i)(s)-2-[4-(4-氯代苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并-[4,3-a][1,4]二氮杂
在一些实施方案中,所述药学可接受的聚合物为醋酸羟丙基甲基纤维素琥珀酸酯。在一些这样的实施方案中,固体分散体中噻吩并三唑并二氮杂
在其他实施方案中,药学可接受的聚合物为pvp。在一些这样的实施方案中,固体分散体中噻吩并三唑并二氮杂
在另一个实施方案中,所述固体分散体由喷雾干燥法得到。
在另一个实施方案中,在固体分散体的x射线粉末衍射图案中,基本上不存在与结晶的式(1a)的噻吩并三唑并二氮杂
在又一个实施方案中,当通过静脉施用时,由所述固体分散体获得的曲线下面积(auc)值为由对照组合物获得的相应auc值的至少0.5倍,其中所述对照组合物包含等价量的结晶的式(1a)的噻吩并三唑并二氮杂
在另一个实施方案中,与不包含聚合物时结晶的式(1a)的噻吩并三唑并二氮杂
在又一个实施方案中,与不包含聚合物时结晶的式(1a所示的噻吩并三唑并二氮杂
在一个实施方案中,无定形的噻吩并三唑并二氮杂
在一个实施方案中,无定形的式(1a)的噻吩并三唑并二氮杂
本公开进一步提供了用于治疗急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml的药物制剂,其包含如本文所述的喷雾干燥的固体分散体和一种或多种药学可接受的赋形剂,所述药学可接受的赋形剂选自由以下物质所构成的组:乳糖一水合物;微晶纤维素;交联羧甲基纤维素钠;胶态二氧化硅;硬脂酸镁;及其组合。在一些实施方案中,药物制剂具有0.55g/cc至0.60g/cc的堆积密度。在一些实施方案中,药物制剂可以是药物胶囊。在一些实施方案中,药物制剂可以是药物片剂。
本公开还提供了用于治疗急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml的药物制剂,其包含:10-15重量%的本文所述的喷雾干燥的固体分散体和醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas),其中噻吩并三唑并二氮杂
附图说明
参照示例性实施方案的附图来阅读时,将会更好的理解前面的发明概述以及下面的对本发明的包含噻吩并三唑并二氮杂
在附图中:
图1a示出了包含固体分散体的比较制剂的溶解情况,其中所述的固体分散体包含25%的化合物(1-1)和eudragitl100-55;
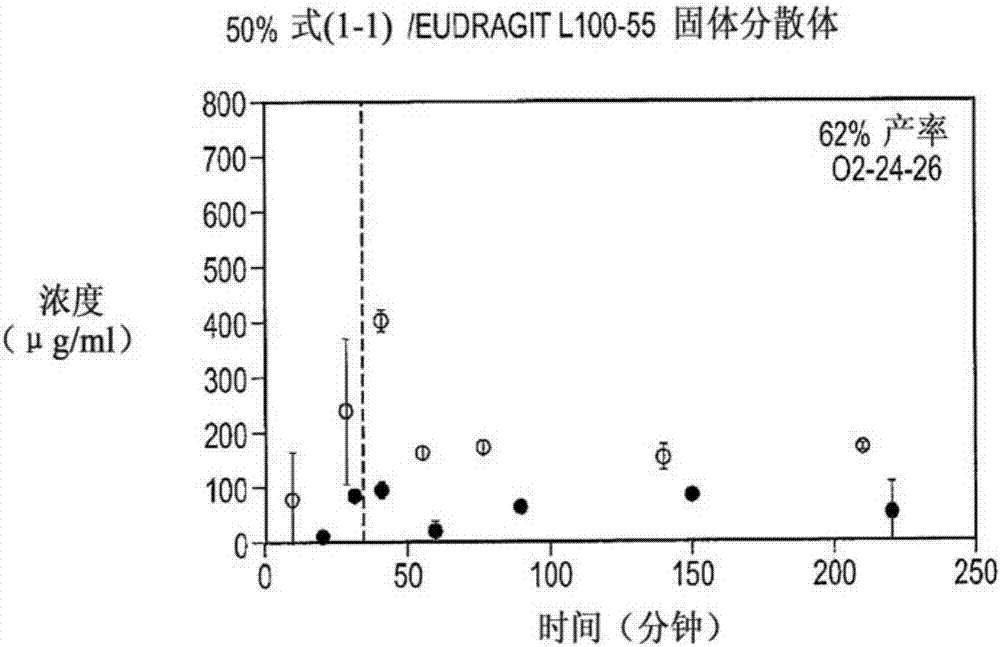
图1b示出了包含固体分散体的比较制剂的溶解情况,其中所述的固体分散体包含50%的化合物(1-1)和eudragitl100-55;
图1c示出了包含固体分散体的示例性制剂的溶解情况,其中所述的固体分散体包含25%的化合物(1-1)和聚乙烯吡咯烷酮(pvp);
图1d示出了包含固体分散体的示例性制剂的溶解情况,其中所述的固体分散体包含50%的化合物(1-1)和pvp;
图1e示出了包含固体分散体的示例性制剂的溶解情况,其中所述的固体分散体包含25%的化合物(1-1)和pvp-乙酸乙烯酯(pvp-va);
图1f示出了包含固体分散体的示例性制剂的溶解情况,其中所述的固体分散体包含50%的化合物(1-1)和和pvp-va;
图1g示出了包含固体分散体的示例性制剂的溶解情况,其中所述的固体分散体包含25%的化合物(1-1)和醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas-m);
图1h示出了包含固体分散体的示例性制剂的溶解情况,其中所述的固体分散体包含50%的化合物(1-1)和hpmcas-m;
图1i示出了包含固体分散体的示例性制剂的溶解情况,其中所述的固体分散体包含25%的化合物(1-1)和羟丙基甲基纤维素邻苯二甲酸酯(hpmcp-hp55);
图1j示出了包含固体分散体的示例性制剂的溶解情况,其中所述的固体分散体包含50%的化合物(1-1)和hmcp-hp55;
图2a示出了示例性制剂的体内筛选结果,该示例性制剂包含25%化合物(1-1)和pvp的固体分散体;
图2b示出了示例性制剂的体内筛选结果,该示例性制剂包含25%化合物(1-1)和hpmcas-m的固体分散体;
图2c示出了示例性制剂的体内筛选结果,该示例性制剂包含50%化合物(1-1)和hpmcas-m的固体分散体;
图3示出了化合物(1-1)的固体分散体的x射线粉末衍射图谱。
图4a示出了在环境条件下平衡的25%化合物(1-1)和pvp的固体分散体的修正的差示扫描量热轨迹;
图4b示出了在环境条件下平衡的25%化合物(1-1)和hpmcas-m的固体分散体的修正的差示扫描量热轨迹;
图4c示出了在环境条件下平衡的50%化合物(1-1)和hpmcas-m的固体分散体的修正的差示扫描量热轨迹;
图5示出了25%化合物(1-1)和pvp或hpmcas-m的固体分散体、以及50%化合物(1-1)和hpmcas-mg的固体分散体的玻璃化转变温度(tg)对相对湿度(rh)的图;
图6示出了在75%相对湿度下平衡的25%化合物(1-1)和pvp的固体分散体的修正的差示扫描量热轨迹;
图7示出了1mg/kg静脉定量给药后的化合物(1-1)(实心矩形)、3mg/kg口服定量给药的25%化合物(1-1):pvp(空心圆圈)、3mg/kg口服定量给药的25%化合物(1-1):hpmcas-mg(空心三角形)和3mg/kg口服定量给药的50%化合物(1-1):hpmcas-mg(空心倒三角)的血浆浓度对时间的曲线。插图描绘了在半对数标度上绘制的相同的数据;
图8示出了化合物(1-1)作为25%化合物(1-1):pvp(空心圆圈)、25%化合物(1-1):hpmcas-mg(空心三角形)和50%化合物(1-1):hpmcas-mg(空心倒三角)在3mg/kg口服定量给药后的血浆浓度对时间的曲线。插图描绘了在半对数标度上绘制的相同的数据;
图9示出了在稳定性测试时间为0时,化合物(1-1)在hpmcas-mg中的固体分散体的x射线粉末衍射图谱;
图10示出了在40℃和75%相对湿度的环境下暴露1个月后,化合物(1-1)在hpmcas-mg中的固体分散体的x射线粉末衍射图谱;
图11示出了在40℃和75%相对湿度的环境下暴露2个月后,化合物(1-1)在hpmcas-mg中的固体分散体的x射线粉末衍射图谱;
图12示出了在40℃和75%相对湿度的环境下暴露3个月后,化合物(1-1)在hpmcas-mg中的固体分散体的x射线粉末衍射图谱;
图13a示出了用化合物(1-1)和各种化合物同时联用处理hl60、u937、jurkat和k562细胞系48小时后的联合指数值;
图13b示出了用氮杂胞苷和化合物(1-1)同时联用处理hl60、u937、jurkat和k562细胞系48小时后的联合指数值;
图13c示出了用帕比司他和化合物(1-1)同时联用处理hl60、u937、jurkat和k562细胞系48小时后的联合指数值;
图14a示出了用氮杂胞苷处理hl60、u937、jurkat和k562细胞系48小时之后依次联用化合物(1-1)处理48小时后的联合指数值;
图14b示出了用氮杂胞苷处理hl60、u937、jurkat和k562细胞系24小时之后依次联用化合物(1-1)处理48小时后的联合指数值;
图14c示出了用氮杂胞苷处理hl60、u937、jurkat和k562细胞系72小时之后依次联用化合物(1-1)处理48小时后的联合指数值;
图14d示出了用氮杂胞苷处理hl60、u937、jurkat和k562细胞系之后依次联用化合物(1-1)处理后的联合指数值的总结;
图15a示出了用帕比司他处理hl60、u937、jurkat和k562细胞系48小时之后依次联用化合物(1-1)处理48小时后的联合指数值;
图15b示出了用帕比司他处理hl60、u937、jurkat和k562细胞系72小时之后依次联用化合物(1-1)处理24小时后的联合指数值;
图15c示出了用帕比司他处理hl60、u937、jurkat和k562细胞系72小时之后依次联用化合物(1-1)处理48小时后的联合指数值;
图15d示出了用帕比司他处理hl60、u937、jurkat和k562细胞系之后依次联用化合物(1-1)处理后的联合指数值的总结;
图16a示出了用化合物(1-1)与氮杂胞苷或帕比司他同时联合处理hl60细胞系24小时后,处于subg1的hl60细胞系的细胞百分比;
图16b示出了用化合物(1-1)与氮杂胞苷或帕比司他同时联合处理k562细胞系24小时后,处于subg1的k562细胞系中细胞百分比;
图17a示出了用化合物(1-1)与氮杂胞苷或帕比司他同时联合处理hl60细胞系24小时后,hl60细胞系中cmyc、切割的胱天蛋白酶3(cleavedcaspase3)、切割的parp(cleavedparp)、p21和β肌动蛋白的蛋白质印迹图;
图17b示出了用化合物(1-1)与氮杂胞苷或帕比司他同时联合处理jurkat细胞系24小时后,jurkat细胞系中cmyc、切割的胱天蛋白酶3、切割的parp、p21和β肌动蛋白的蛋白质印迹图;
图17c示出了用化合物(1-1)与氮杂胞苷或帕比司他同时联合处理u937细胞系24小时后,u937细胞系中cmyc、切割的胱天蛋白酶3、切割的parp、p21和β肌动蛋白的蛋白质印迹图;以及
图17d示出了用化合物(1-1)与氮杂胞苷或帕比司他同时联合处理k562细胞系24小时后,k562细胞系中cmyc、切割的胱天蛋白酶3、切割的parp、p21和β肌动蛋白的蛋白质印迹图;
图18示出了用化合物(1-1)处理72小时的hl60、u937、jm·kat、molt3和k562细胞系的gi50和emax;
图19a示出了对于hl60、u937、jurkat、molt3和k562细胞系,化合物(1-1)的细胞外水平相对于时间的图;
图19b示出了对于hl60、u937、jurkat、molt3和k562细胞系,化合物(1-1)的细胞内水平相对于时间的图;
图20a示出了用化合物(1-1)处理5、15、30、60、120和360分钟的hl60细胞系中c-myc和tublin的蛋白质印迹图;
图20b示出了用化合物(1-1)处理5、15、30、60、120和360分钟的hl60细胞系中c-myc水平的荧光强度;
图20c示出了用化合物(1-1)处理5、15、30、60、120和360分钟的hl60细胞系中化合物(1-1)的胞外和胞内水平;
图21a示出了用化合物(1-1)处理5、15、30、60、120和360分钟的jurkat细胞系中c-myc和微管蛋白(tublin)的蛋白质印迹图;
图21b示出了用化合物(1-1)处理5、15、30、60、120和360分钟的jurkat细胞系中c-myc水平的荧光强度;
图21c示出了用化合物(1-1)处理5、15、30、60、120和360分钟的jurkat细胞系中化合物(1-1)的胞外和胞内水平;
图22a示出了用化合物(1-1)处理5、15、30、60、120和360分钟的u937细胞系中c-myc和tublin的蛋白质印迹图;
图22b示出了用化合物(1-1)处理5、15、30、60、120和360分钟的u937细胞系中c-myc水平的荧光强度;
图22c示出了用化合物(1-1)处理5、15、30、60、120和360分钟的u937细胞系中化合物(1-1)的胞外和胞内水平;
图23a示出了用化合物(1-1)处理5、15、30、60、120和360分钟的k562细胞系中c-myc和tublin的蛋白质印迹图;
图23b示出了用化合物(1-1)处理5、15、30、60、120和360分钟的k562细胞系中c-myc水平的荧光强度;
图23c示出了用化合物(1-1)处理5、15、30、60、120和360分钟的k562细胞系中化合物(1-1)的胞外和胞内水平;
图24a示出了用500nm化合物(1-1)处理5、15、30、60、120和360分钟的hl60、u937、jurkat、molt3和k562的bcl2的荧光强度;
图24b示出了用500nm化合物(1-1)处理5、15、30、60、120和360分钟的hl60、u937、jurkat、molt3和k562的p21的荧光强度;
图24c示出了用500nm化合物(1-1)处理5、15、30、60、120和360分钟的hl60、u937、jurkat、molt3和k562的brd2的荧光强度;
图24d示出了用500nm化合物(1-1)处理5、15、30、60、120和360分钟的hl60、u937、jurkat、molt3和k562的brd3的荧光强度;
图24e示出了用500nm化合物(1-1)处理5、15、30、60、120和360分钟的hl60、u937、jm·kat、molt3和k562的brd4的荧光强度;和
图24f示出了用500nm化合物(1-1)处理5、15、30、60、120和360分钟的hl60、u937、jurkat、molt3和k562的hexim1的荧光强度。
发明详述
现在,下文将参照附图和实施例来更全面地描述本发明的主题,所述附图和实施例示出了代表性的实施方案。但是,本发明的主题可以以不同的形式体现,并且不应该解释成局限于本发明列出的实施方案。提供这些实施方案旨在描述并使本领域的技术人员能够实施。除非另有说明,否则本发明所用的所有技术和科学术语都具有所述主题所属技术领域的普通技术人员通常所理解的相同的含义。本发明中所提及的所有公开、专利申请、专利和其他参考文献均以引用的方式全文并入本文中。
i.定义
本文所用的术语“烷基”是指饱和的直链或支链烃。
术语“取代的烷基”是指具有一个或多个取代基的烷基部分,其中所述的取代基替代了烃主链上的氢或者一个或多个碳。
无论术语“烯基”是单独使用还是作为取代基的一部分(例如“c1-4烯基(芳基)”)使用,都是指具有至少一个碳-碳双键部分的部分不饱和支链或直链一价烃基团,其中所述的双键是通过由母体烷基分子的两个相邻碳原子的每个碳原子上除去一个氢原子而得到的,并且所述基团是通过由一个碳原子上除去一个氢原子而得到的。原子可以在双键周围以顺式(z)或反式(e)构象来排布。典型的烯基基团包括但不限于乙烯基、丙烯基、烯丙基(2-丙烯基)、丁烯基等。例子包括c2-8烯基或c2-4烯基。
术语“c(j-k)”(其中j和k为整数,表示碳原子的指定数量)是指烷基以包含j至k个碳原子(包含端值)的前置代号的脚注来显示的烷基、烯基、炔基、烷氧基或环烷基基团,或者指基团中的烷基部分。例如c(1-4)表示包含1、2、3或4个碳原子的基团。
如本文所用,术语“卤代”或“卤素”是指f、cl、br或i。
术语“药学可接受的盐”是本领域公认的,并且是指化合物的相对无毒性的无机酸和有机酸加成盐,或者有机碱或无机碱加成盐,包括(例如)在本发明的组合物中所包含的那些。
如本文所用,术语“固体分散体”是指一组固体产物,其由至少两种不同的组分组成,通常为亲水性载体和疏水性药品(活性成分)。
术语“手性的”是本领域公认的,并且是指具有镜像对应部分的非重叠性性质的分子,而术语“非手性”是指可重叠在它们镜像对应部分上的分子。”前手性分子”是指在特定的过程中具有转化成手性分子的潜力的分子。
符号
术语“对映异构体”和用于描述对映异构体的结构式意指包含“纯的”对映异构体,其不包含光学异构体以及对映异构体及其光学异构体的混合物,其中对映异构体以对映异构体过量而存在,例如至少10%、25%、50%、75%、90%、95%、98%或99%对映异构体过量。
当在本文中使用术语“立体异构体”时,由所有的几何异构体、对映异构体或非对映异构体组成。本发明涵盖了这些化合物和它们的混合物的多种立体异构体。此外,所公开的化合物的构象异构体和旋转异构体也被包括在内。
如本文所用,术语“立体选择合成”是指这样的化学或酶反应,其中单一的反应物在建立新的立构中心的过程中或者在转化现有的立构中心的过程中形成了立体异构体的不均匀的混合物,并且这些反应是本领域公知的。立体选择合成涵盖了对映选择性和非对映选择性的转化。例如参见carreira,e.m.和kvaerno,l.,classicsinstereoselectivesynthesis,wiley-vch:weinheim,2009。
术语“喷雾干燥”是指其中涉及将供料悬液或溶液雾化成小滴并在处理室(其中具有用于蒸发的强驱动力,例如热干气、部分真空或它们的组合)中快速除去混合物中的溶剂的工艺。
如本文所用,术语“治疗有效量”是指这样的任何量,与未接受此量的噻吩并三唑并二氮杂
术语“约”是指+/-10%。
在本申请及随附的权利要求书的全文中,除非上下文中必须另外说明,否则词语“包括”或其变体(例如“包含”或“包含有”)都应该解释为包括所述的整数或步骤、或者一组整数或步骤,并且但不排除任何其他的整数或步骤、或一组整数或步骤。
目前已经发现,下文所述的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)可包括:具有9%乙酰基/11%琥珀酰基的m级(例如,平均粒径为5μm的hpmcas(即,hpmcas-mf,细粉级)或平均粒径为1mm的hpmcas(即,hpmcas-mg,颗粒级));具有12%乙酰基/6%琥珀酰基的h级(例如,平均粒径为5μm的hpmcas(即,hpmcas-hf,细粉级)或平均粒径为1mm的hpmcas(即,hpmcas-hg,颗粒级));以及具有8%乙酰基/15%琥珀酰基的l级(例如,平均粒径为5μm的hpmcas(即,hpmcas-lf,细粉级)或平均粒径为1mm的hpmcas(即,hpmcas-lg,颗粒级))。
在一些实施方案中,聚乙烯吡咯烷酮的分子量可为约2,500(
ii.治疗方法
在一些实施方案中,本公开提供了治疗急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml的方法,包括施用根据本文所述的药学上可接受量的组合物。
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml的方法,该方法包括:向需要的患者施用药学可接受的量的组合物,该组合物包含根据本文第iii、iv、v和vi部分所描述的任意组合物的固体分散体。
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml方法,该方法包括:向需要的患者施用药学可接受的量的组合物,该组合物包含根据本文第iii、iv、v和vi部分所描述的任意组合物的药物制剂。
在一些实施方案中,治疗急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml的方法利用了下式(1)的噻吩并三唑并二氮杂
其中
r1为具有1至4个碳的烷基;r2为氢原子、卤素原子、或任选地被卤素原子或羟基取代的具有1至4个碳的烷基;r3为卤素原子,任选地被卤素原子、具有1至4个碳的烷基、具有1至4个碳的烷氧基、或氰基取代的苯基,-nr5-(ch2)m-r6,其中r5为氢原子、或具有1至4个碳的烷基,m为0至4的整数,并且r6为任选地被卤素原子取代的苯基或吡啶基;或-nr7-co-(ch2)n-r8,其中r7为氢原子或具有1至4个碳的烷基,n为0至2的整数,并且r8为任选地被卤素原子取代的苯基或吡啶基;并且r4为-(ch2)a-co-nh-r9,其中a为1至4的整数,并且r9为具有1至4个碳的烷基,具有1至4个碳的羟烷基,具有1至4个碳的烷氧基,或任选地被具有1至4个碳的烷基、具有1至4个碳的烷氧基、氨基或羟基取代的苯基或吡啶基,或-(ch2)b-coor10,其中b为1至4的整数,并且r10为具有1至4个碳的烷基。
在一些实施方案中,式(1)选自式(1a),其药学可接受的盐或水合物;以及药学可接受的聚合物:
其中,x为卤素,r1为c1-c4烷基,r2为c1-c4烷基,a为1至4的整数,r3为c1-c4烷基、c1-c4羟烷基、c1-c4烷氧基、任选地具有取代基的苯基、或任选地具有取代基的杂芳基。在一个这样的实施方案中,将噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病的方法,该方法包括:向需要的患者施用药学可接受的量的组合物,该组合物包含根据本文第iii、iv、v和vi部分所描述的任意组合物的药物制剂。
急性髓细胞白血病包括血癌和骨髓癌,其中骨髓产生异常的成髓细胞、纤细胞或血小板。急性髓细胞白血病包括但不限于由世界卫生组织分类的急性髓细胞白血病的亚类以及由法国美国-英国(fab)合作组分类的急性髓细胞白血病的亚类。在一些实施方案中,急性髓细胞白血病可以是混合型谱系白血病(mll)融合阳性、正jak2突变型真性红细胞增多症或骨髓增生异常综合征。在一些实施方案中,急性髓细胞白血病是急性嗜碱性白血病、伴有骨髓纤维化的急性全骨髓增殖症或髓细胞样肉瘤。在一些实施方案中,急性髓细胞白血病是急性成髓细胞白血病(最小分化)、急性成髓细胞白血病(未成熟)、急性成髓细胞白血病(伴随粒细胞成熟)、急性早幼粒细胞白血病、急性骨髓单核细胞性白血病、伴随骨髓嗜酸性粒细胞增多的骨髓单核细胞性白血病、急性单核母细胞白血病、急性单核细胞白血病、急性红细胞性白血病或急性巨核细胞白血病。在一些实施方案中,急性髓细胞白血病是伴随复发性遗传异常的急性髓细胞白血病、伴随多向性的急性髓细胞白血病或治疗相关的急性髓性白血病。伴随复发性遗传异常的aml包括但不限于具有(8;21)(q22;q22)的aml、具有inv(16)(p13q22)或t(16;16)(p13;q22)的aml、具有t(15;17)(q22;q12)的aml以及具有11q23异常的aml。在一些实施方案中,治疗相关的aml包括但不限于烷化剂相关的aml或拓扑异构酶ii抑制剂相关的aml。
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并三氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性髓细胞白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性淋巴细胞性白血病的方法,其包括:向需要的患者施用药学上可接受量的组合物,所述组合物包含根据本文第iii、iv、v和vi部分所述的任意组合物的药物制剂。
在一些实施方案中,急性淋巴细胞性白血病可以分类为all-l1。在其他实施方案中,急性淋巴细胞性白血病可以分类为all-l2。在其他实施方案中,急性淋巴细胞性白血病可以分类为all-l3。在一些实施方案中,急性淋巴细胞性白血病可以分类为前体b急性淋巴细胞性白血病或前b细胞急性淋巴细胞性白血病。在其他实施方案中,急性淋巴细胞性白血病可以分类为前体t急性淋巴细胞白血病或前t细胞急性淋巴细胞性白血病。在一些实施方案中,前体b急性淋巴细胞性白血病可以具有细胞遗传亚型t(12;21)(p12,q22)tel/aml-1;t(1;19)(q23;p13)pbx/e2a;t(9;22)(q34;q11)ablibcr;或t(v,11)(v;q23)v/mll。在一些实施方案中,急性淋巴细胞性白血病是伯基特氏白血病。在一些实施方案中,急性淋巴细胞性白血病是双表型急性白血病。
在一些实施方案中,本公开提供了治疗哺乳动物中的急性淋巴细胞性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性淋巴细胞性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性淋巴细胞性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性淋巴细胞性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性淋巴细胞性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性淋巴细胞性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的急性淋巴细胞性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供治疗哺乳动物中的慢性急性髓性白血病的方法,其包括:向需要的患者施用药学上可接受量的组合物,所述组合物包含根据本文第iii、iv、v和vi部分所述的任意组合物的药物制剂。
在一些实施方案中,慢性急性髓性白血病可以处于慢性期。在其他实施方案中,慢性急性髓细胞白血病可以处于加速期。在其他实施方案中,慢性急性髓细胞白血病可以处于爆发急变期。
在一些实施方案中,本公开提供了治疗哺乳动物中的慢性急性髓性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的慢性急性髓性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的慢性急性髓性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的慢性急性髓性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的慢性急性髓性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的慢性急性髓性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的慢性急性髓性白血病的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中的高风险脊髓发育不良综合征和/或hr-mds/aml的方法,包括:向需要的患者施用药学上可接受量的组合物,所述组合物包含根据本文第iii、iv、v和vi部分所述的任意组合物的药物制剂。
在一些实施方案中,本公开提供了治疗哺乳动物中高风险脊髓发育不良综合征和/或hr-mds/aml的方法,包括:施用药学上可接受量的式(1)噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中高风险脊髓发育不良综合征和/或hr-mds/aml的方法,包括:施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中高风险脊髓发育不良综合征和/或hr-mds/aml的方法,包括:施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中高风险脊髓发育不良综合征和/或hr-mds/aml的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中高风险脊髓发育不良综合征和/或hr-mds/aml的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中高风险脊髓发育不良综合征和/或hr-mds/aml的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在一些实施方案中,本公开提供了治疗哺乳动物中高风险脊髓发育不良综合征和/或hr-mds/aml的方法,其包括施用药学上可接受量的式(1)的噻吩并三唑并二氮杂
在本发明的方法中,与式(1)的噻吩并三唑并二氮杂类联合使用的合适的糖皮质激素包括但不限于下表a中所列的糖皮质激素。
表a
在本发明的方法中,与式(1)的噻吩并三唑并二氮杂
表b
在本发明的方法中,与式(1)的噻吩并三唑并二氮杂
表c
在本发明的方法中与式(1)的噻吩并三唑并二氮杂
表d
本文所用的哺乳动物受试者可以是任何哺乳动物。在一个实施方案中,哺乳动物受试者包括但不限于人;非人灵长类动物;啮齿动物如小鼠、大鼠或豚鼠;家养宠物如猫或狗;马、牛、猪、绵羊、山羊或兔。在一个实施方案中,哺乳动物受试者包括但不限于鸟,例如鸭、鹅、鸡或火鸡。在一个实施方案中,哺乳动物受试者是人。在一个实施方案中,哺乳动物受试者可以是任何性别,并且可以是任何年龄。
在本发明中,“治疗(treatment)”或“治疗(treat)”是指这样一种行为或动作,其将本发明的活性成分施用给由医生诊断为具有急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml的患者、或者存在罹患急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml风险的患者,其目的是(例如)减轻急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml(或其相同的症状),预防急急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml(或其相同的症状),或恢复急性髓细胞白血病、急性淋巴细胞性白血病、高风险脊髓发育不良综合征和/或hr-mds/aml发病前的状态。
iii.噻吩并三唑并二氮杂
在一个实施方案中,在本发明的制剂中使用的噻吩并三唑并二氮杂
其中r1为具有1至4个碳的烷基;r2为氢原子、卤素原子、或任选地被卤素原子或羟基取代的具有1至4个碳的烷基;r3为:卤素原子,任选地被卤素原子、具有1至4个碳的烷基、具有1至4个碳的烷氧基、或氰基取代的苯基,-nr5-(ch2)m-r6,其中r5为氢原子、或具有1至4个碳的烷基,m为0至4的整数,并且r6为任选地被卤素原子取代的苯基或吡啶基,或-nr7-co-(ch2)n-r8,其中r7为氢原子或具有1至4个碳的烷基,n为0至2的整数,并且r8为任选地被卤素原子取代的苯基或吡啶基;并且r4为:-(ch2)a-co-nh-r9,其中a为1至4的整数,并且r9为具有1至4个碳的烷基,具有1至4个碳的羟烷基,具有1至4个碳的烷氧基,或任选地被具有1至4个碳的烷基、具有1至4个碳的烷氧基、氨基或羟基取代的苯基或吡啶基,或-(ch2)b-coor10,其中b为1至4的整数,并且r10为具有1至4个碳的烷基。
在一个实施方案中,合适的烷基包括含有1个碳原子至4个碳原子的直链或支链烷基基团。在一个实施方案中,合适的烷基包括含有1个碳原子至3个碳原子的直链或支链烷基基团。在一个实施方案中,合适的烷基包括含有1个碳原子至2个碳原子的直链或支链烷基基团。在一个实施方案中,示例性的烷基基团包括但不限于甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基。在一个实施方案中,示例性的烷基基团包括但不限于甲基、乙基、丙基、异丙基、2-甲基-1-丙基和2-甲基-2-丙基。
在一些实施方案中,本发明提供了本发明所述的噻吩并三唑并二氮杂
本发明提供了本发明所述的噻吩并三唑并二氮杂
式(1)所示化合物的某些同位素标记形式(例如引入了放射性同位素的那些)可用于药品和/或底物的组织分布研究中。由于放射性同位素氚(3h)和碳-14(14c)易于引入和即时的检测手段,所以它们特别适用于上述目的。使用较重的同位素(例如氘(2h))进行取代可以提供由于更广的代谢稳定性而产生的某些治疗益处,例如体内半衰期增长或者剂量需求降低,因此,在一些情况下可以是优选的。使用发射正电子的同位素(例如11c、18f、15o和13n)进行取代可以用于正电子发射断层成像术研究(pet)中,以用于检测底物受体的占用。
在一些实施方案中,本发明公开的噻吩并三唑并工氮杂
在一些实施方案中,本发明所述的噻吩并三唑并二氮杂
在一些实施方案中,本发明所述的噻吩并三唑并二氮杂
此外,由取代基围绕碳-碳双键的排列或者取代基围绕环烷基或杂环的排列而产生的几何异构体也可以存在于本发明的化合物中。在一些实施方案中,符号
在一些实施方案中,本发明所公开的噻吩并三唑并二氮杂
在一些实施方案中,本发明所公开的噻吩并三唑并二氮杂
对于一对映异构体对而言,可以使用以下等式(等式(1))来计算对映异构体e1相对于对映异构体e2的对映异构体过量百分比:
可以通过手性高效液相色谱(hplc)、核磁共振(nmr)或任何其他合适的方法来测定e1和e2的相对量。在一些实施方案中,对映异构体化合物的纯度可以指对映异构体e1和e2相对于其他材料的量,这些其他物质特别包括副产物和/或未反应的反应物或试剂。
在一些实施方案中,式(1)的噻吩并三唑并二氮杂
表a:本发明的示例性化合物:
表a(续)
表a(续)
在一些实施方案中,式(1)所示的噻吩并三唑并二氮杂
在一些实施方案中,式(1)所示的噻吩并三唑并二氮杂
iv.制剂:
式(1)所示的化合物在盖伦组合物的常规给药和制备方面表现出非常特有的困难,特别包括药物生物利用度以及患者间和患者内的剂量应答的可变性的特定问题,由此需要针对几乎水不溶性的所述化合物开发非常规的剂型。
之前,已经发现可以利用载体丙烯酸乙酯-甲基丙烯酸甲酯-三甲基铵乙基甲基丙烯酸酯氯化物共聚物(eudragitrs,由rohm公司制造)将式(1)所示的化合物配置成固体分散体,从而提供在下肠道中优先释放药物组分以用于治疗炎性肠病(例如溃疡性结肠炎和克罗恩病)的口服制剂(2009年1月8日公开的美国专利申请20090012064a1)。通过多个实验(包括动物试验),发现就炎性肠病而言,药物在病变部位的释放及其对炎性病变的直接作用比其由胃肠道吸收至循环中更为重要。
现在,意外地发现根据式(1)所示的噻吩并三唑并二氮杂
固体分散体为改善水溶性差的药物的口服生物利用度的一种手段。
如本文所用,术语“固体分散体”是指一组固体产物,其包含至少2种不同的成分,通常为亲水性载体和疏水性药物(根据式(1)的噻吩并三唑并二氮杂
在一个实施方案中,根据式(1)的噻吩并三唑并二氮杂
在一个实施方案中,本发明提供了包含固体分散体的药物组合物,其中所述固体分散体由以下形成:根据式(1)的噻吩并三唑并二氮杂
在一个实施方案中,本发明提供了一种药物组合物,其包含式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含无定形形式的式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含无定形形式的式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含结晶形式的式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含结晶形式的式(1)所示的噻吩并三唑并二氮杂
在一些实施方案中,通过喷雾干燥来制备包含固体分散体的药物组合物。
在一个实施方案中,本发明的药物组合物包含喷雾干燥的固体分散体,该固体分散体由以下形成:式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含喷雾干燥的固体分散体,该固体分散体由以下形成:式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含喷雾干燥的固体分散体,该固体分散体由以下形成:无定形的式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含喷雾干燥的固体分散体,该固体分散体由以下形成:无定形的式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含喷雾干燥的固体分散体,该固体分散体由以下形成:结晶形式的式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含喷雾干燥的固体分散体,该固体分散体由以下形成:结晶形式的式(1)所示的噻吩并三唑并二氮杂
在一个优选的实施方案中,本发明提供了一种药物组合物,其包含固体分散体,该固体分散体由以下形成:2-[(6s)-4-(4-氯代苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f]-[1,2,4]三唑并[4,3-a][1,4]二氮杂
在一个实施方案中,药学可接受的聚合物为hpmcas。在一个实施方案中,分散体中化合物(1-1)和hpmcas的重量比为1∶3至1∶1。在一个实施方案中,至少一部分噻吩并三唑并二氮杂
在另一个实施方案中,所述药物组合物包含化合物(1-1)或其药学可接受的盐、溶剂化物(包括水合物)、消旋物、对映异构体、异构体或同位素标记形式;以及药学可接受的聚合物的固体分散体。在一个实施方案中,药学可接受的聚合物为pvp。在一个实施方案中,分散体中化合物(1-1)和pvp的重量比为1∶3至1∶1。在一个实施方案中,至少一部分噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含无定形形式的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含无定形形式的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含结晶形式的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包含结晶形式的噻吩并三唑并二氮杂
当经口施用本发明所述的固体分散体时,其表现出特别有利的性质。当在动物或人类的标准生物利用度试验中施用时,所述固体分散体的有利性质的例子包括但不限于一致的且高水平的生物利用度。本发明的固体分散体可以包括含有式(1)所示的噻吩并三唑并二氮杂
可以通过沿着相对于横坐标(x轴)的时间的纵坐标(y轴),绘制式(1)所示的噻吩并三唑并二氮杂
可以通过模拟胃环境和肠环境的ph值的体外测试来测量生物利用度。可以通过以下方法进行测量:将式(1)所示的噻吩并三唑并二氮杂
在其他的实施方案中,在ph值为1.0至2.0的水性体外测试介质中,与不包含聚合物的结晶的式(1)所示的噻吩并三唑并二氮杂
在其他的实施方案中,所述固体分散体中的无定形的式(1)所示的噻吩并三唑并二氮杂
在一些实施方案中,当在一定的湿度和温度下暴露一段时间时,本发明所述的固体分散体表现出抵抗式(1)所示的噻吩并三唑并二氮杂
v.剂型:
可以用于本发明的固体分散体的合适的剂型包括但不限于胶囊、片剂、小型片剂、珠、微囊剂(beadlet)、丸剂、小颗粒(granule)、粒剂(granulate)和粉末。可以使用例如肠溶包衣来包裹合适的剂型。合适的包衣可以包括但不限于邻苯二甲酸乙酸纤维素、羟丙基甲基纤维素(hpmc)、羟丙基甲基纤维素邻苯二甲酸酯、聚甲基丙烯酸共聚物、或醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)。在一些实施方案中,可存在某些组合,例如,在同一样品中,本发明的噻吩并三唑并二氮杂
在一些实施方案中,本发明的固体分散体可以配制成片剂、囊片或胶囊。在一些实施方案中,本发明的固体分散体可以配制成小型片剂或倒入口中(pour-into-mouth)的小颗粒、或者成分(constitution)的口服粉末。在一些实施方案中,本发明的固体分散体与其他的赋形剂(例如,抑制重结晶/沉淀的聚合物、掩味成分等)组合并分散于合适的稀释剂中,从而提供即用型的悬浮制剂。在一些实施方案中,本发明的固体分散体可以配制用于儿科治疗。
在一个实施方案中,本发明的药物组合物被配制用于口服给药。在一个实施方案中,所述的药物组合物包含根据本发明所述的多个实施方案的固体分散体,其包含:式(1)所示的噻吩并三唑并二氮杂
用于所述的药物组合物含义合适的药学可接受的润滑剂和药学可接受的助流剂的实例包括但不限于胶态氧化硅、三硅酸镁、淀粉、滑石、三碱式磷酸钙、硬脂酸镁、硬脂酸铝、硬脂酸钙、碳酸镁、氧化镁、聚乙二醇、粉末状纤维素、甘油二十二烷酸酯、硬脂酸、氢化蓖麻油、单硬脂酸甘油酯和硬脂酰富马酸钠。
用于所述的药物组合物的合适的药学可接受的粘结剂的实例包括但不限于:淀粉、纤维素及其衍生物,例如微晶纤维素(例如avicelph,得自fmc公司)、羟丙基纤维素、羟乙基纤维素和羟丙基甲基纤维素(hpmc,例如methocel,得自dowchemical公司);蔗糖、右旋糖、玉米糖浆;多糖和明胶。
用于所述的药物组合物的合适的药学可接受的填料和药学可接受的稀释剂的实例包括但不限于:糖果制造商的糖、可压缩糖、葡萄糖结合剂、糊精、右旋糖、乳糖、甘露醇、微晶纤维素(mcc)、粉末状纤维素、山梨醇、蔗糖和滑石。
在一些实施方案中,在所述的药物组合物中,赋形剂可以发挥多于一种的功能。例如,填料或粘结剂还可以为崩解剂、助流剂、抗粘附剂、润滑剂、甜味剂等。
在一些实施方案中,本发明的药物组合物可以还包含添加剂或配料,例如抗氧化剂(例如抗坏血酸棕榈酸酯、丁基化羟基茴香醚(bha)、二丁基化羟基甲苯(bht)、α-生育酚、丙基没食子酸盐和富马酸)、抗微生物剂、酶抑制剂、稳定剂(例如丙二酸)和/或防腐剂。
通常,本发明的药物组合物可以配制成任何合适的固体剂型。在一些实施方案中,本发明的固体分散体混合在单位剂型中,例如作为胶囊或片剂、或者多微粒系统(例如小颗粒或粒剂、或者粉末),以用于给药。
在一个实施方案中,药物组合物包含:根据本发明所述的固体分散体的多个实施方案的式(1)所示的噻吩并三唑并二氮杂
vi.剂量:
在一个实施方案中,本发明提供了可以配制成任何合适的固体剂型的药物组合物。在一个实施方案中,根据本发明的药物组合物包含本发明所述式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包括向有需要的受试者施用本发明所述多种实施方案中的一种或多种的式(1)所示的噻吩并三唑并二氮杂
在一个实施方案中,本发明的药物组合物包括向有需要的受试者施用选自由以下化合物构成的组中的噻吩并三唑并二氮杂
根据特定的治疗目的、治疗阶段等,所述单位剂型适合每日给药1至5次。在一个实施方案中,有需要的受试者可以至少连续两天每日至少1次施用该剂型。在一个实施方案中,有需要的受试者可以至少隔日并每日至少1次施用该剂型。在一个实施方案中,有需要的受试者可以至少每周施用该剂型,并且将该剂型分成相等的和/或不等的剂量。在一个实施方案中,有需要的受试者可以每周施用该剂型,每隔3天和/或每周6次施用。在一个实施方案中,有需要的受试者可以每隔1天、每3天、每4天、每5天、每6天和/或每周以分剂量施用该剂型。在一个实施方案中,有需要的受试者可以每个月服用该剂型的2个或多个等分剂量或非等分剂量。
可以使用例如肠溶包衣来包裹所用的剂型(例如胶囊、片剂、小型片剂、珠、微囊剂、丸剂、小颗粒、粒剂或粉末)。合适的包衣可以包括但不限于邻苯二甲酸乙酸纤维素、羟丙基甲基纤维素(hpmc)、羟丙基甲基纤维素邻苯二甲酸酯、聚甲基丙烯酸共聚物、或醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)。
vii.工艺:
本发明所公开的噻吩并三唑并二氮杂
如果需要,本发明所公开的噻吩并三唑并二氮杂
本发明的固体分散体可以通过多种方法来制备,包括熔融和溶剂蒸发方法。本发明的固体分散体还可以根据如下文中所描述的工序制备:chiouwl,riegelmans:“pharmaceuticalapplicatiohsofsoliddispersionsystems”,j.pharm.sci.1971;60:1281-1302;serajuddinatm:“soliddispersionofpoorlywater-solubledrugs:earlypromises,subsequentproblems,andrecentbreakthroughs”,j.pharm.sci.1999;88:1058-1066;leunerc,dressmanj:“improvingdrugsolubilityfororaldeliveryusingsoliddispersions”,eur.j.pharm.biopharm.2000;50:47-60;以及vasconcelost,sarmentob,costap:“soliddispersionsasstrategytoimproveoralbioavailabilityofpoorwatersolubledrugs”,drugdiscoverytoday2007;12:1068-1075,所有这些文献均以引用的方式将其全文并入本文中。
在一个实施方案中,本发明的固体分散体是通过熔融工艺制备的。在一个实施方案中,熔融工艺包括在载体中将式(1)的噻吩并三唑并二氮杂
在一些实施方案中,式(1)的噻吩并三唑并二氮杂
在一个实施方案中,通过将熔融物喷雾至冷却室(使环境温度或冷却温度的低温空气通过该冷却室)中以将熔融物形成颗粒,从而使熔融的药品和载体的混合物冷却或固化。在一个实施方案中,通过在合适的流化床处理器中使熔融分散体雾化和再固化,从而使熔融的药品和载体混合物冷却和固化。在一个实施方案中,通过在可加热的高剪切混合器中进行熔融制粒,从而使熔融的药品和载体的混合物冷却并固化。
在一些实施方案中,可以采用热阶段挤出(hot-stageextrusion)或熔融团聚物来避免药物的熔融局限。热阶段挤出包括如下过程:在熔融温度下将预先混合的药品和载体以高转速在短时间内挤出;在室温下冷却后收集所得的产物并研磨。
在一个实施方案中,将式(1)的噻吩并三唑并二氮杂
在一些实施方案中,通过溶剂蒸发方法来制备根据式(1)的噻吩并三唑并二氮杂
在一个实施方案中,根据本发明的固体分散体的制备包括使悬浮于挥发性溶剂中的一种或多种赋形剂干燥。在一个实施方案中,所述的干燥包括真空干燥、使挥发性溶剂在低温下缓慢蒸发、使用旋转蒸发仪、喷雾干燥、喷雾制粒、冷冻干燥或使用超临界流体。
在一个实施方案中,使用了喷雾干燥制备根据式(1)的噻吩并三唑并二氮杂
在一些实施方案中,根据本发明的固体分散体的制备包括使用超临界流体。术语“超临界流体”是指在临界温度和临界压力以上以单一液相存在的物质。在一个实施方案中,根据本发明的制剂的制备包括使用超临界二氧化碳流体。在一个实施方案中,利用超临界流体技术制备根据本发明的制剂,其包括:将根据式(1)的噻吩并三唑并二氮杂
在一些实施方案中,根据本发明的固体分散体的制备包括使用共沉淀方法。在一个实施方案中,在持续搅拌下将非溶剂滴加至根据式(1)的噻吩并三唑并二氮杂
对于式(1)的化合物与聚合物载体(一种或多种)的混合比例没有特别限定,只要其可以改善式(1)的化合物的生物利用率即可,并且该比例根据聚合物的种类而改变。
通过以下非限定性例子来说明本发明。
viii.例子:
通过以下非限定性例子来说明本发明。
实施例1:化合物(1-1)的固体分散体的体外筛选
使用化合物(1-1)以及五种聚合物中的一种来制备一种固体分散体,其中所述聚合物包括醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas-m)、羟丙基甲基纤维素邻苯二甲酸酯(hpmcp-hp55)、聚乙烯吡咯烷酮(pvp)、pvp-乙酸乙烯酯(pvp-va)和eudragitl100-55,并且对于每种聚合物,化合物(1-1)的负载率为25%和50%。使用喷雾干燥,然后在低温对流烘箱中进行二次干燥,从而通过溶剂蒸发法来制备固体分散体。通过非沉降溶解性能测试(non-sinkdissolutionperformancetest)来评估各固体分散体的性能,所述测试测量药物的总量和随着时间溶液中所存在的游离药物的量。选择非沉降溶解是由于其能够最好地代表低溶解度化合物在体内的情况。该测试包括在分散体被引入至测试介质后约30分钟至40分钟,分散体由胃ph(0.1nnacl,ph1.0)至肠ph(fafssif,ph6.5)的“胃转移”,从而模拟了体内的情况。[fafssif为禁食状态的人工肠液,其由3mm的牛黄胆酸钠、0.75mm的卵磷脂、0.174gnaoh颗粒、1.977gnah2po4·h2o、3.093gnacl和适量纯净水500ml组成]。使用高效液相色谱(hplc)法和agilent1100串联hplc来定量溶解药物的量。制剂的溶解情况(图1a-1j)表明:相对于在相同介质中的未经配制的化合物而言,在所有的分散体候选物中,药物的溶解度均大幅升高。在所有的固体分散体中,基于在肠ph下释放的游离药物的水平较高这一发现可知,与未经配制的化合物相比,25%化合物(1-1)在pvp中的分散体、25%化合物(1-1)在hpmcas-m中的分散体、以及50%化合物(1-1)在hpmcas-m中的分散体提供了增强的经口吸收。
实施例2:化合物(1-1)的固体分散体的体内筛选
以更大的规模制备化合物(1-1)的固体分散体,即25%化合物(1-1)在pvp中的分散体、25%化合物(1-1)在hpmcas-mg中的分散体、以及50%化合物(1-1)在hpmcas-m中的分散体,以用于体内研究。各制剂均经过了实施例1所述的体外溶解测试的评估。为了确保这些分散体是无定形且均质的,通过x射线粉末衍射法(pxrd)和修正的差示扫描量热法(mdsc)来评估各分散体。x射线衍射计为brukerd-2phaser。另外,为了了解水对各种分散体的玻璃化转变温度(tg)的影响,对首先在设定的相对湿度(即,25%、50%和75%rh)下平衡至少18小时的样品进行mdsc。[水可以用作固体分散体的增塑剂,并且由活性化合物或聚合物导致的体系的吸湿性可以影响被这些体系吸收的水的量]。
非沉降溶解结果(图2a-2c)与实施例1中分散体的结果相当。pxrd结果(图3)显示没有证据表明任意一种分散体中存在结晶化合物,并且mdsc结果(图4a-4c)显示各分散体均存在单一的玻璃化转变温度(tg),这表明各分散体是均匀的。对于各分散体,观察到tg与相对湿度之间逆相关(图5)。值得注意的是,对于在75%rh下平衡的25%化合物(1-1)在pvp中的固体分散体,出现了两个tg,这表明发生了相分离,并且该分散体还显示出在75%rh下发生了熔化,这表明在rh平衡过程中发生了结晶(图6)。该发现表明25%化合物(1-1)在pvp中的分散体的稳定性弱于hpmcas-m分散体。
为了评估这三种分散体的生物利用度,向多组雄性猎兔犬(每组3只)施用剂量为3mg/kg的化合物(1-1)的固体分散体的水性悬液(通过口服填喂法给药),或者施用剂量为3mg/kg的溶解于水∶乙醇∶聚乙二醇(peg)400(60∶20∶20)中的化合物(1-1)(并以静脉推注给药至头静脉中)。在静脉给药后的0分钟(服药之前)、5分钟、15分钟和30分钟、和1小时、2小时、4小时、8小时、12小时和24小时,以及在口服填喂给药后的0分钟(服药之前)、15分钟和30分钟、和1小时、2小时、4小时、8小时、12小时和24小时由各动物的颈静脉收集血液样品。使用合格的lc-ms/ms法检测各样品中存在的化合物(1-1)的量,并且量化下限为0.5ng/ml。通过使用线性梯形法则(直至最终可测的浓度,而未将终末消除相外推至无穷大)来测定血浆浓度-时间曲线的曲线下面积(auc)。通过对对数浓度-时间曲线的终末线性部分进行最小二乘回归分析来计算消除半衰期(t1/2)。由血浆浓度数据直接得到最大血浆浓度(cmax)和达到cmax的时间(tmax)。通过用口服给药后的剂量归一化的auc除以静脉给药后的剂量归一化的auc来计算口服生物利用度(f),并以百分数(%)形式报告。下表1中总结的结果给出了25%化合物(1-1)在pvp中的固体分散体、25%化合物(1-1)在hpmcas-m中的固体分散体和50%化合物(1-1)在hpmcas-m中的固体分散体的平均口服生物利用度,分别为58%、49%和74%。
表1:狗口服(po)和静脉(iv)给药后的化合物(1-1)的药物动力学参数(数值为3只狗的平均值)
auc:血浆浓度-时间曲线下的面积;cmax:最大血浆浓度;f:生物利用度;hpmcas:醋酸羟丙基甲基纤维素钠;iv:静脉内;peg:聚乙二醇;po:经口,口服;pvp:聚乙烯吡咯烷酮;tmax:达到cmax的时间;t1/2:血浆消除半衰期
实施例3:包含化合物(1-1)的固体分散体的胶囊的制备和临床应用
制备10mg强度的明胶胶囊,在患有恶性血液病的患者中进行初步的临床研究。基于实施例1和2中所述的化合物(1-1)的固体分散体的体外和体内测试结果,选择50%化合物(1-1)在hpmcas-m中的固体分散体用于胶囊的研发。以3号尺寸的硬明胶胶囊,190mg的填充量为目标来开始胶囊的研发,因为这样的构造可以通过填充更大尺寸的胶囊而潜在地增加胶囊的强度,同时保持药物组合物。根据经验,设计了4种胶囊制剂,其中具有不同量的崩解剂并且具有或不具有润湿剂。由于所有4种制剂都显示出相似的崩解测试和溶解测试结果,所以选择最简单的制剂(不具有润湿剂,并具有最少量的崩解剂)用于制造。进行制造工艺的研发和规模扩大的研究,以确定固体分散体的喷雾干燥工艺和干燥后的时间;共混的参数;为获得约0.60g/cc的目标堆密度的共混物的辊压和研磨;以及胶囊填充的条件。
将结晶化合物(1-1)和聚合物醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas-m)溶解于丙酮中,并喷雾干燥,从而生产包含50%化合物(1-1)载量的固体分散体中间体(sdi)颗粒。pxrd分析显示sdi是无定形的,mdsc分析显示sdi是均匀的(即在环境条件下具有单一的tg)。在v型搅拌机的多个段中将50%化合物(1-1)在hpmcas-m中的固体分散体(1000g)和赋形剂(包括微晶纤维素填料-粘结剂(4428g)、交联羧甲基纤维素钠崩解剂(636g)、胶体二氧化硅分散剂/润滑剂(156g)、硬脂酸镁分散剂/润滑剂(156g)和乳糖一水合物填料(5364g))共混。然后将混合物压制并制粒,从而得到约0.6g/ml的堆密度。使用自动化的填充机将混合物分配至3号尺寸的硬明胶胶囊(目标填充量:190mg)中,并使用胶囊抛光机将制得的胶囊抛光。
在口服给药10mg胶囊(包含50%化合物(1-1)在hpmcas中的固体分散体)后进行药物动力学的评估,并将结果与对健康志愿者口服给药4x10mg胶囊(其包含化合物(1-1)的eudragit固体分散体)后进行的药物动力学评估加以对比。
在下表2a和2b中提供了这两种药物组合物的比较。之前的eudragit制剂在2009年1月8日公开的美国专利申请2009/0012064a1中的实施例5中有所描述。该申请记载:通过在水和乙醇的混合物中溶解和/或分散式(a)所示的噻吩并三唑并二氮杂
在这两个临床研究中,使用经验证的lc-ms/ms方法来测定化合物(1-1)的血液水平,并根据在胶囊给药后24小时内各时间点测量的化合物(1-1)的血浆浓度来进行药物动力学分析。下表3中总结的结果显示,根据auc(924*4/1140,由于给药剂量的差异而改变),hpmcas-m固体分散体制剂在人中的生物利用度比eudragit固体分散体制剂高3倍以上。此外,根据观察到的tmax,hpmcas制剂的吸收速度快于eudragit制剂(tmax为1小时vs4-6小时)。hpmcas-m固体分散体制剂的在系统暴露方而的明显改善是意料之外的。
表2a:用于临床应用的化合物(1-1)的固体分散体胶囊
包含化合物(1-1)的50%hpmcas固体分散体的药物组合物:10mg强度,3号尺寸的硬明胶胶囊
表2b:包含化合物(1-1)的eudragitl100-55固体分散体的药物组合物:10mg强度,2号尺寸的硬明胶胶囊
*为无水形式
表3:在将化合物(1-1)的固体分散体经口施用给人后的药物动力学参数
auc0-24h:24小时内otx015血浆浓度对时间曲线下的面积
cmax:最大血浆浓度
hr:小时
hpmcas:醋酸羟丙基甲基纤维素琥珀酸酯
ml:毫升
ng:纳克
po:经口,口服
tmax:达到cmax的时间
实施例4:在大鼠中的口服暴露
在大鼠中测定化合物(1-1)的固体分散体的3种制剂的口服生物利用度。所选的3种分散体为25%化合物(1-1)在pvp中的分散体、25%化合物(1-1)在hpmcas-mg中的分散体和50%化合物(1-1)在hpmcas-mg中的分散体。在该研究中使用的动物为得自土尔库大学(芬兰)的中央动物实验室(centralanimallaboratory)的无特定病体(spf)的hsd:spraguedawley大鼠。大鼠最初购自位于荷兰的harlan。大鼠为雌性,并且为10周龄,12只大鼠用于该研究中。在聚碳酸酯makrolonii笼中饲养动物(每个笼中3只),动物室温为21+/-3℃,动物室内的相对湿度为55+/-15%,并且动物室内照明为人工照明,而且为12小时明暗周期的循环(暗周期为18:00至06:00之间)。白杨木屑(tapveioy,estonia)用于垫料,并且每周至少更换1次垫料。在对动物定量给药之前提供食物和水,但是在定量给药后最初的2个小时中移除食物和水。
将预先计算的量的注射用无菌水加入至装有采用合适的量的分散体的容器中,获得化合物(1-1)的浓度为0.75mg/ml,由此制备包含25%化合物(1-1)在pvp中的分散体的口服定量给药溶液、包含25%化合物(1-1)在hpmcas-mg中的分散体的口服定量给药溶液和包含50%化合物(1-1)在hpmcas-mg中的分散体的口服定量给药溶液。
在每次给药之前,将口服定量给药溶液进行涡旋混合20秒。用于静脉给药的定量给药溶液包含0.25mg/ml的化合物(1-1),该定量给药溶液是通过将5mg的化合物(1-1)溶解于这样的混合物中来制备的,所述混合物包含4ml的平均分子量为400da的聚乙二醇(peg400)、4ml的乙醇(96%纯度)和12ml的注射用无菌水。在加入水后的30分钟之内使用含有25%化合物(1-1)在pvp中的分散体的定量给药溶液。在加入水后的60分钟之内使用含有25%化合物(1-1)在hpmcas-mg中的分散体的定量给药溶液和含有50%化合物(1-1)在hpmcas-mg中的分散体的定量给药溶液。使用4ml/kg定量给药量,从而使化合物(1-1)的静脉给药的给药水平为1mg/kg,口服给药的给药水平为3mg/kg。定量给药方案在表4中给出。
表4.用于大鼠口服暴露研究的定量给药方案
在定量给药后的0.25小时、0.5小时、1小时、2小时、4小时、8小时、12小时和24小时的时间点,将约50μl的血液样品收集至包含5μl乙二胺四乙酸(edta)溶液的eppendorf管中,并且每个样品都是在距所述时间点5分钟时间窗内收集的。由各样品获得20μl血浆并储存在于冰温度下以用于分析。使用经验证的液相色谱串联质谱(lc-ms/ms)法对各样品中化合物(1-1)的浓度进行分析,其定量下限为0.5ng/ml。
使用phoenixwinnonlin软件包(6.2.1版,pharsightcorp公司,ca,usa),采用标准的非房室模型方法来计算药物动力学参数。通过对对数浓度-时间曲线的终末线性部分进行最小二乘回归分析来计算消除半衰期(t1/2)。通过使用线性梯形法则直至最终可测的浓度,此后将终末消除相外推至无穷大来测定血浆浓度-时间曲线的曲线下面积(auc)。通过将药物浓度曲线外推至无穷大来计算平均保留时间(mrt),其代表了化合物在房室或系统中保留的平均时间量。由血浆浓度数据直接得到最大血浆浓度(cmax)和达到cmax的时间(tmax)。通过用口服给药后的剂量归一化的auc除以静脉给药后的剂量归一化的auc来计算试验性口服生物利用度(f),即f=(auc(口服)/剂量(口服))/(auc(静脉)/剂量(静脉))],并以百分数(%)形式报告。
药物动力学参数在表5中给出,血浆浓度对时间的图示于图7和8中。
表5.口服和静脉给药后的化合物(1-1)的药物动力学参数。值为得自3只动物的平均值。
实施例5.喷雾干燥分散体的制备
使用五种所选的聚合物来制备化合物(1-1)的喷雾干燥的分散体,这5种聚合物为:hpmcas-mg(shinetsuchemical公司)、hpmcp-hp55(shinetsuchemical公司)、pvp(isp,ashland公司的部门)、pvp-va(basf公司)和eudragitl100-55(evonikindustriesag)。使用每种聚合物以25%和50%制备所有的喷雾干燥溶液。除了pvp溶液以外,所有的溶液都是在丙酮中制备的,pvp溶液是在乙醇中制备的。对于各溶液而言,在10g溶剂中制备1.0g固体(聚合物和化合物(1-1))。使用具有1.5mm喷嘴的büchib-290,pe-024喷雾干燥器和büchib-295,p-002冷凝器将溶液喷雾干燥。将喷雾干燥器的喷嘴压力设定为80psi,目标出口温度设定为40℃,冷却器的温度设定至-20℃,泵速设定为100%,并且抽吸器设定为100%。在喷雾干燥后,收集固体分散体,并在低温对流烘箱中过夜干燥,从而除去残余的溶剂。
实施例6:湿度和温度的稳定性
通过在高温下暴露于水分来评估化合物(1-1)在hpmcas-mg中的喷雾干燥分散体的稳定性。通过在75%相对湿度和40℃下放置1、2和3个月,来测定作为相对湿度的函数的玻璃化转变温度(tg)。在hdpe瓶中将喷雾干燥的分散体储存在ldpe袋内,从而模拟散装物品包装。结果总结于表6中。在时间0时,tg为134℃,在1个月时tg为134℃,在2个月时tg为135℃,在3个月时tg为134℃,并且在各测量中仅观测到单一的拐点。对每种样品还获得了x射线衍射图谱。图9示出了在稳定性测试的时间0时,化合物(1-1)在hpmcas-mg中的固体分散体的x射线粉末衍射图谱。图10、11和12示出了分别在暴露于40℃和75%相对湿度1个月、2个月和3个月后,化合物(1-1)在hpmcas-mg中的固体分散体的x射线粉末衍射图谱。
实施例7.体外研究
用递增剂量的化合物(1-1)处理来自急性(hl-60、u-937)和慢性(k-562、nalm-1)急性髓细胞白血病和急性淋巴细胞性白血病(jurkat、ccrf-cem、molt-3/-4),72小时后进行mtt测定。通过蛋白质印迹分析蛋白质,并在steponeplus实时pcr系统上用fastsybrgreen进行qrt-pcr。对化合物(1-1)与dna甲基转移酶(氮杂胞苷、地西他滨)、广谱hdac抑制剂(帕比司他)、mtor抑制剂(依维莫司)、糖皮质激素(地塞米松)、和常规细胞毒性药物(柔红霉素、阿糖胞苷和甲氨蝶呤)的同时施用和按顺序施用的方案进行评价。使用chou&talalay分析确定联合指数(ci);ci<1反映协同作用,ci=1反映累加作用,ci>1反映拮抗作用。
在hl60、u937和jurkat中,单一药剂化合物(1-1)的抗增殖效果产生的gi50介于230nm至384nm之间,对于其他细胞系而言产生的为2∶6,000nm。在3种化合物(1-1)敏感型细胞系(hl60、u937、jurkat)和一种化合物(1-1)耐受性细胞系(k-562)中进行组合研究。在全部4种细胞系中,化合物(1-1)与氮杂胞苷(ci=0.6;0.6-0.7)、地西他滨(ci=0.6;0.3-0.9)、阿糖胞苷(ci=0.8;0.4-0.9)、柔红霉素(ci=0.8;0.4-0.9)和甲氨蝶呤(ci=0.2;0.1-0.3)的48小时共同联合具有协同作用。在hl60、k562和jurkat细胞系中,地塞米松、依维莫司和帕比司他与化合物(1-1)具有协同作用。在4种细胞系中,在使用氮杂胞苷或帕比司他后施加化合物(1-1)的按顺序组合方案中,48-48小时、72-24小时或72-48小时的方案显示出比共同处理更强的协同作用,在72-24小时后出现最低ci值。在hl-60细胞中,化合物(1-1)(500nm)与氮杂胞苷(311μm)或帕比司他(20nm)的24小时组合增加了半胱天冬酶-3和parp切割,而在k562细胞中,该组合增加p21的表达,增强c-myc的下调。
实施例8.体外研究
用递增剂量的化合物(1-1)处理来自急性(hl60、u937)或慢性(k562)髓细胞样白血病细胞和急性淋巴细胞性白血病细胞(jurkat)的四种确认的人细胞系。在暴露72小时之后,进行mtt测定。使用prism5.00,通过s形剂量反应的方程式计算gi50和emax值,并将细胞系分类为敏感型或耐受型。gi50值<500nm的细胞系被认为是化合物(1-1)敏感型。在hl60、u937和jurkat中,单药剂化合物(1-1)的抗增殖效果产生的gi50介于230nm至384nm之间,对于其他细胞系而言产生的为2′:6,000nm。
对化合物(1-1)与去甲基化剂(氮杂胞苷、地西他滨)、广谱hdac抑制剂(帕比司他)、mtor抑制剂(依维莫司)、糖皮质激素(地塞米松)、和常规细胞毒性药物(柔红霉素、阿糖胞苷和甲氨蝶呤)的共同联用进行评价。使用chou&talay分析测定联合指数(ci):ci<1反映协同作用,ci=1反映累加作用,ci>1反映拮抗作用。结果示于图13a中。
在化合物(1-1)敏感型和耐受型白血病细胞中,化合物(1-1)与去甲基化剂、hdac和mtor抑制剂、糖皮质激素和常规细胞毒性药物的共同联合施用都发挥了强的协同作用。如图13a所示,在全部4种细胞系中,化合物(1-1)与氮杂胞苷(ci=0.6;0.6-0.7)、地西他滨(ci=0.6;0.3-0.9)、阿糖胞苷(ci=0.8;0.4-0.9)、柔红霉素(ci=0.8;0.4-0.9)和甲氨蝶呤(ci=0.2;0.1-0.3)的8小时共同联合都具有协同作用。在hl60、k562和jurkat细胞系中,地塞米松、依维莫司和帕比司他与化合物(1-1)产生协同。此外,图13b示出了氮杂胞苷和化合物(1-1)的联合指数值,该指数值针对用氮杂胞苷和化合物(1-1)共同联合处理48小时的hl60、u937、jurkat和k562细胞系。图13c示出了用帕比司他和化合物(1-1)的联合指数值,该指数值针对用帕比司他和化合物(1-1)共同联合处理48小时的hl60、u937、jurkat和k562细胞系。
在三种化合物(1-1)敏感型细胞系(hl60、u937、jurkat)和一种耐受型细胞系(k-562)中进行按顺序联用研究。如图14a-14d所示,在4种细胞系中,在使用氮杂胞苷后施加化合物(1-1)的按顺序联用方案中,48-48小时、72-24小时或72-48小时的方案显示出比共同处理更强的协同作用,在72-24小时联用后出现最低ci值。在72小时-48小时的联用后观察到最低的ci值。如图15a-15d所示,在4种细胞系中,在使用帕比司他后施加化合物(1-1)的按顺序组合方案中,48-48小时、72-24小时或72-48小时的方案显示出比共同处理更强的协同作用,在72-24小时后出现最低ci值。
对于化合物(1-1)(500nm)与氮杂胞苷(3f.lm)或帕比司他(20nm)的24小时联用,在hl-60细胞系中进行细胞周期研究。图16a和16b示出了用化合物(1-1)与氮杂胞苷或帕比司他共同联合处理24小时的hl60和k562细胞系的subg1的细胞百分比。在hl60细胞中,共同暴露于化合物(1-1)和氮杂胞苷增加了subg1期细胞的百分比,而在k562细胞中,联用增加了g1期细胞的百分比。
图17a-d分别示出了hl60、jurkat、u937和k562细胞系的cmyc、切割的半胱天冬酶3、切割的parp、p21和β-肌动蛋白的蛋白质印迹图,所述细胞系用化合物(1-1)和氮杂胞苷或帕比司他共同联合处理24小时。在hl-60细胞系中,化合物(1-1)(500nm)与氮杂胞苷(3f.lm)或帕比司他(20nm)的24小时联用增加了半胱天冬酶-3和parp的切割,而在k562细胞系中,该联用增加了p21表达并增强了c-myc下调。
实施例9.体外研究
使用来自急性和慢性急性髓细胞白血病(hl-60、u937、k562)和急性淋巴细胞性白血病(jurkat、molt-3)的5种确认的人细胞系。72小时暴露后,通过mtt和gi50值评价化合物1-1的抗增殖效果。对于细胞pk研究,将细胞以2.106细胞/ml接种,并暴露于500nm的化合物1-1分别0分钟、5分钟、15分钟、30分钟、60分钟、120分钟和360分钟。在每个时间点,利用超高效液相色谱-串联质谱法(浓度范围1-250ng/ml),分别在细胞上清液和细胞团中分析化合物1-1的胞外浓度和胞内浓度。一式四份进行实验。此外,在细胞团中,使用市售抗体通过蛋白质印迹分析蛋白质调节,并使用fastsybrgreen在steponeplusrt-pcr系统上进行qrt-pcr。
在hl60、u937和jurkat中,gi50值在230nm至384nm之间,对于其他细胞系而言为2:6,000nm。在敏感型和耐受型白血病细胞系这两者中,化合物1-1的细胞摄取都很快(<5分钟),平均浓度为~15ng/106细胞(3-23ng.ml-1/106细胞),而化合物1-1的细胞外水平在直到孵育6小时才稳定(~200ng.ml-1)。在耐受型细胞系k562中,我们观察到暴露2小时后cmycmrna水平下调,即使在暴露5分钟后就检测到了化合物1-1的胞内水平也是如此。在敏感型细胞系(hl60和jurkat)中,观察到cmyc蛋白和mrna水平迅速下调,这与化合物1-1的快速摄取相关,而在敏感细胞系中,其它的化合物1-1靶向基因(如hexim、p21和bcl2mrna水平)在较长暴露时间后才被调节。
在化合物1-1敏感型和耐受型白血病细胞系中,在相似的时间点以相似的程度出现化合物1-1的胞内积累。仅在敏感型细胞系中观察到化合物1-1靶基因在mrna和蛋白质水平的快速调节。
实施例10.化合物(1-1)在罹患血液恶性肿瘤患者的ib期剂量探索研究中的药物动力学
本发明人进行化合物(1-1)的肿瘤ib期试验,主要目的在于研究对患有急性白血病或其他血液恶性肿瘤的患者施用剂量递增的化合物(1-1)的情况。本研究纳入了罹患急性白血病或其他血液恶性肿瘤的患者。根据不同的给药方案,患者接受几种活性剂量水平的化合物(1-1),范围为10mg至160mg。在第1天,对于白血病患者(“完全pk”)在施用后24小时内,从每个患者体内收集来自7个时间点的血样,并且对于其他血液恶性肿瘤患者(“限制性pk”),在施用后8小时内,从每个患者体内收集4个血样。基于上述血样,使用浓度范围为1-250ng/ml的经验证的超高效液相色谱法和串联质谱检测测定化合物(1-1)的血浆浓度。使用非线性混合效应建模软件程序monolix版本4.3进行分析和群体药代动力学(ppk)建模。计算药物动力学参数,包括吸收常数(ka);表观分布体积(v/f)、表观清除率(cl/f)和瘦体重(lbm;根据患者性别、体重和身高计算)。
85名患者参加化合物(1-1)的ib期试验,并于2013年1月至2014年8月接受治疗。给患者随机分配6个剂量水平:10mg、20mg、40mg、80mg、120mg和160mg,每天给药一次(qd);和40mg每天给药两次(bid)。其中,81例血浆浓度为630(607±23blq)的患者可以进行pk评估评价。1室开放模型充分描述了总化合物(1-1)浓度-时间曲线。对于结构模型获得的群体药代动力学(ppk)参数为ka=0.74h-1(12%);v/f=71.7l(6.0%)和cl/f=8.45l/h(5.0%)。观察到化合物(1-1)auc值和剂量之间的最佳相关性为10mg至120mg剂量水平(r2=0.84)。吸收相是线性的,tmax在1小时和4小时之间。化合物(1-1)对所有患者30的平均消除半衰期为5.8小时(±1.1)。在ppk研究中,当在分析中考虑lbm时获得最佳模拟模型。对于化合物(1-1),还观察到cl/f和v/f之间的相关性。
本领域技术人员应该理解的是,在不脱离本发明的宽泛的发明构思的条件下可以对上文所示的并描述的示例性实施方案进行修改。因此,应该理解的是本发明不限于所示的并描述的示例性实施方案,其旨在涵盖在权利要求书所限定的本发明的精神和范围内的修改。例如,示例性实施方案的特定特征可以为所要求保护的发明的一部分或不是其一部分,并且所公开的实施方案的特征可以结合。除非本发明作出具体说明,术语“一个”、“一种”和“所述”不限于一个元素,而是应该理解为“至少一个”。
应该理解的是,本发明的至少一些特征和描述被简化为集中于与清楚地理解本发明有关的元素,同时为了清晰起见,除去了本领域普通技术人员将理解的其他元素(也可以包含本发明的一部分)。但是由于此类元素是本领域公知的,并且由于它们不一定会更有利于更好地理解本发明,所以在本发明中未提供此类元素的描述。
此外,所述的方法并非依赖于本发明列出的步骤的特定顺序,就此而言,步骤的特定顺序不应该解释为对权利要求的限定。涉及本发明的方法的权利要求不应该限于书写顺序的步骤的性能,并且本领域的技术人员可以容易理解这些步骤可以改变,并且仍然保持在本发明的精神和范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种紫外线吸收剂uv-234的制备方法
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑5-甲基间苯二甲酸锰配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑镉混配配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑间苯二甲酸镉配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑锌混配配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑三维锌配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑对苯二甲酸铜配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-双三唑均苯四酸铜配合物单晶与应用
- 一种4-苯基-3-((4,6-二甲基嘧啶-2-基硫代)甲基)-5-苄硫基三唑类化合物及其应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑二维铜配合物单晶与应用